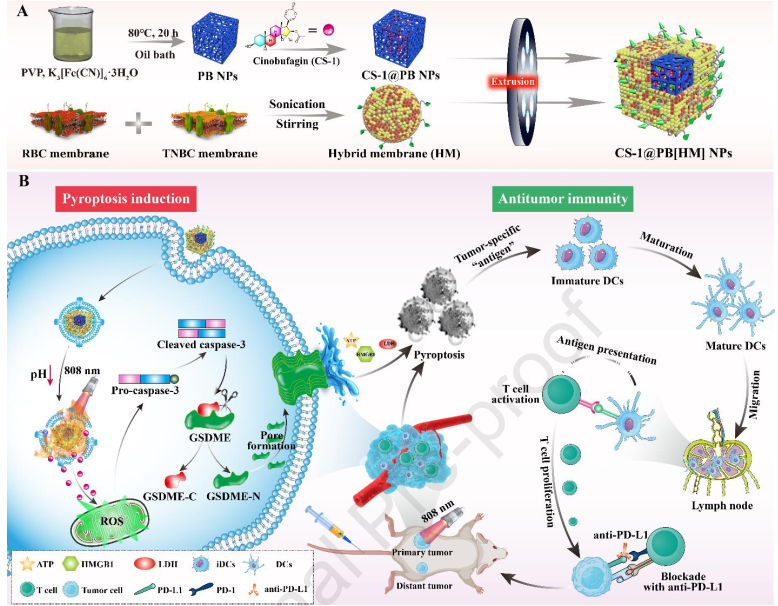
药物诱导的免疫原性死亡(ICD)可通过释放肿瘤相关抗原激活局部和全身免疫系统,以有效抑制肿瘤的生长和复发。细胞焦亡是一种能够诱导ICD的有效过程。然而,如何将细胞焦亡诱导剂高效递送到肿瘤细胞内仍然是一项严峻的挑战。研究发现,蟾素的主要成分华蟾素(CS-1)可以有效诱导三阴性乳腺癌(TNBC)发生细胞焦亡,使其成为能够治疗此类肿瘤的潜在药物选择。然而,CS-1的大剂量/长时间使用以及全身毒性等问题也极大地限制了其在体内的应用。为了解决这些问题,湖南大学刘斌教授和湖南中医药大学王炜教授将CS-1装入普鲁士蓝纳米颗粒(PB NPs)中,从而开发了一种新型纳米药物。
本文要点:
(1)这种新型纳米药物可以通过光热控制的方式释放PB纳米粒子中CS-1。此外,实验也利用混合膜(HM)伪装策略提高了该纳米药物的免疫逃逸和肿瘤靶向性。体外实验表明,化学-光热联合处理能够产生高水平的ICD,以最终促进树突状细胞(DC)的成熟。
(2)体内抗肿瘤实验结果进一步表明,该策略不仅可以有效地抑制MDA-MB-231细胞和4T1细胞等模型的原发肿瘤,而且也能够通过促进DCs成熟、增强细胞毒性T淋巴细胞的肿瘤浸润和抑制Treg细胞等机制抑制4T1异种移植模型的远端肿瘤生长。综上所述,该研究合理设计了一种基于纳米材料的多模态纳米药物,能够为治疗三阴性乳腺癌提供一种新的高效策略。
Ying Long. et al. Biomimetic Prussian blue nanocomplexes for chemo photothermal treatment of triple-negative breast cancer by enhancing ICD. Biomaterials. 2023
https://www.sciencedirect.com/science/article/pii/S0142961223003770



















