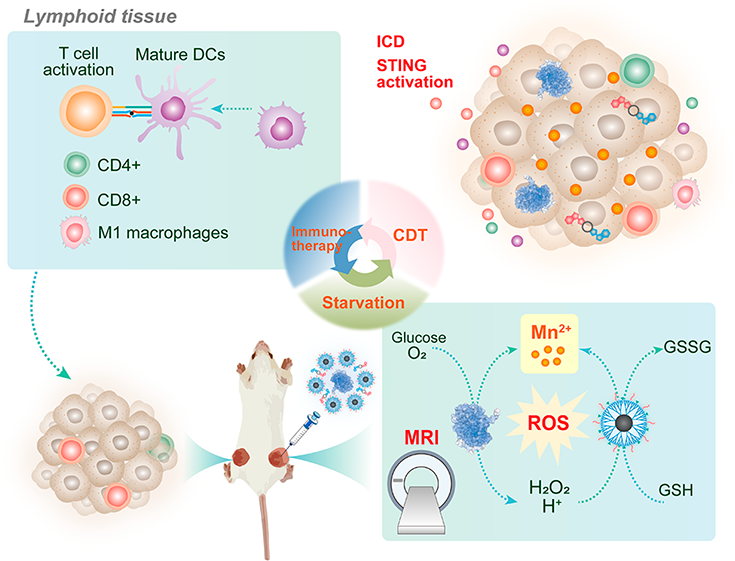
如何开发既能发挥有效的肿瘤治疗效果,又能产生所需的抗肿瘤免疫应答的纳米级药物递送系统是一项极具挑战性的难题。有鉴于此,东华大学史向阳教授和沈明武研究员构建了一种包封二氧化锰(MnO2)的树状聚合物纳米载体,并将其用于共递送葡萄糖氧化酶(GOx)和环GMP-AMP(cGAMP,一种干扰素基因刺激因子(STING)激动剂),以改善肿瘤化学动力学/饥饿/免疫治疗。
本文要点:
(1)实验首先合成了甲氧基聚乙二醇(mPEG)和苯硼酸(PBA)修饰的第5代(G5)聚(酰胺-胺)树状聚合物,并利用其对MnO2纳米粒子(NPs)进行包封以构建杂化的MnO2@G5-mPEG−PBA(MGPP) NPs。具有粒径为2.8 nm的MnO2内核的MGPP纳米粒子能够高效地消耗谷胱甘肽和释放Mn2+,其在模拟肿瘤微环境的条件下可实现类芬顿反应和T1加权的磁共振(MR)成像。研究发现,MGPP介导的GOx递送有助于在体外增强对癌细胞的化学动力学/饥饿治疗,而共递送的cGAMP则可以有效触发免疫原性细胞死亡(ICD),以显著地促进树突状细胞的成熟。
(2)在小鼠双侧结直肠肿瘤模型中,该树状聚合物纳米递送系统能够表现出强大的抗肿瘤性能和远端效应,可大大提高小鼠的总体生存率。实验结果表明,该树突状分子介导的共递送不仅能够实现Mn2+与GOx和cGAMP的协同作用,以进行化学动力学/饥饿治疗触发的ICD和增强的STING激活,促进全身抗肿瘤免疫应答,而且还可以实现T1加权的肿瘤磁共振成像。综上所述,该研究设计的纳米平台能够为增强抗肿瘤治疗的免疫应答提供重要的借鉴和参考。
Yue Gao. et al. Manganese Dioxide-Entrapping Dendrimers Co-Deliver Protein and Nucleotide for Magnetic Resonance Imaging-Guided Chemodynamic/Starvation/Immune Therapy of Tumors. ACS Nano. 2023
DOI:
https://pubs.acs.org/doi/10.1021/acsnano.3c08174



















