低剂量放疗(LDR)对于实现免疫抑制性肿瘤微环境(TME)的炎症化而言具有重要意义。重庆大学罗忠教授、李孟桓教授、Yingqi Liu和重庆金凤实验室田甘教授发现在肿瘤细胞中,对FABP依赖的脂滴生物生成是LDR诱发细胞毒性和免疫刺激效应的关键决定因素,并基于此开发了一种纳米整合策略,以通过协同铁死亡免疫治疗来促进LDR的抗肿瘤疗效。
本文要点:
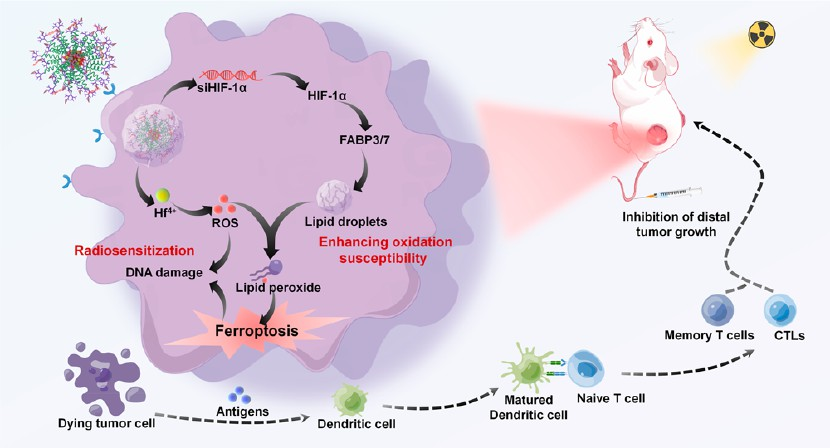
(1)实验合成了具有自组装能力的纳米级多组分功能聚合物TCPP-TK-PEGPAMAM-FA,以用于协同包封铪离子(Hf4+)和抑制HIF-1α的siRNA(siHIF-1α)。TCPP@Hf-TK-PEG-PAMAM-FA@siHIF-1α纳米组装体会被过度表达叶酸受体的肿瘤细胞特异性摄取,并被升高的细胞ROS应激所激活。研究发现,siHIF-1α可以通过HIF-1α-FABP3/7信号通路抑制肿瘤细胞中FABP3/7的表达,并通过抑制脂滴的生物发生来增强膜脂的过氧化敏感性,从而在Hf4+增强辐射暴露的背景下协同升高ROS应激,并在重要的膜结构中诱导铁死亡损伤。
(2)实验结果表明,TCPP@Hf-TK-PEG-PAMAM-FA@siHIF-1α增强的铁死亡生物膜损伤能够促进肿瘤相关抗原(TAAs)的暴露,以增强LDR后的免疫治疗效果,实现肿瘤的有效消退。综上所述,该研究开发了一种利用肿瘤固有的脂质代谢来增强LDR的抗肿瘤作用的新方法。
Qiqi Zhang. et al. Nanointegrative In Situ Reprogramming of Tumor-Intrinsic Lipid Droplet Biogenesis for Low-Dose Radiation-Activated Ferroptosis Immunotherapy. ACS Nano. 2023
DOI: 10.1021/acsnano.3c08907
https://pubs.acs.org/doi/10.1021/acsnano.3c08907



















