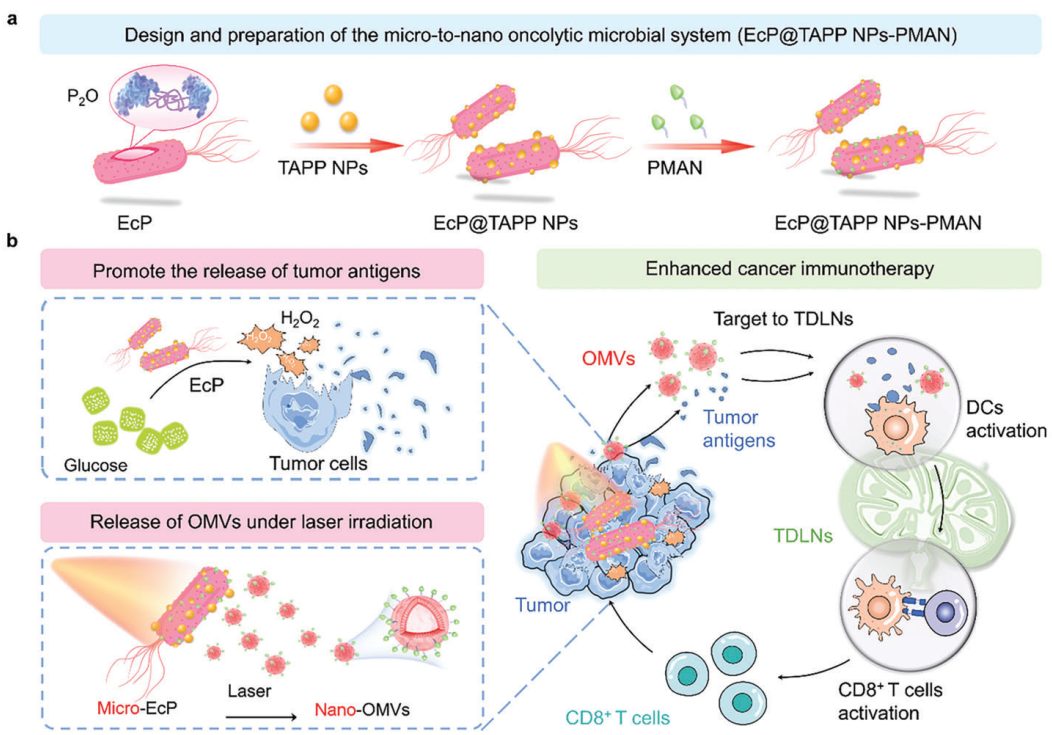
由于肿瘤引流淋巴结(TDLNs)微环境具有免疫抑制作用,因此溶瘤微生物诱导的肿瘤抗原无法在TDLNs中通过抗原提呈细胞(如树突状细胞(DCs))充分交叉启动对肿瘤特异性T细胞的激活。有鉴于此,沈阳药科大学孙进教授和孙孟驰副教授开发了基于过表达吡喃糖氧化酶(P2O)的大肠杆菌(EcP)的微-纳米溶瘤微生物系统,并同时利用聚乙二醇化甘露糖和低浓度光敏剂纳米颗粒(NPs)对其进行包裹。
本文要点:
(1)给药后,该系统中的P2O会产生有毒的过氧化氢,使肿瘤消退,并释放肿瘤抗原。研究发现,"微米级"的EcP会被激光照射所触发,从而分泌"纳米级"的细菌外膜囊泡(OMVs)。
(2)OMVs增强的TDLNs递送能够显著调节TDLNs的免疫微环境,以促进DCs成熟,增强肿瘤抗原特异性T细胞免疫应答。综上所述,该研究构建的微-纳米溶瘤微生物不仅可以发挥肿瘤杀伤作用,也能够重塑TDLNs,以实现对DC的强效激活,从而为微生物肿瘤疫苗的构建与应用提供了一个新的策略。
Zhichao Chen. et al. Micro-to-Nano Oncolytic Microbial System Shifts from Tumor Killing to Tumor Draining Lymph Nodes Remolding for Enhanced Immunotherapy. Advanced Materials. 2023
DOI: 10.1002/adma.202306488
https://onlinelibrary.wiley.com/doi/10.1002/adma.202306488



















