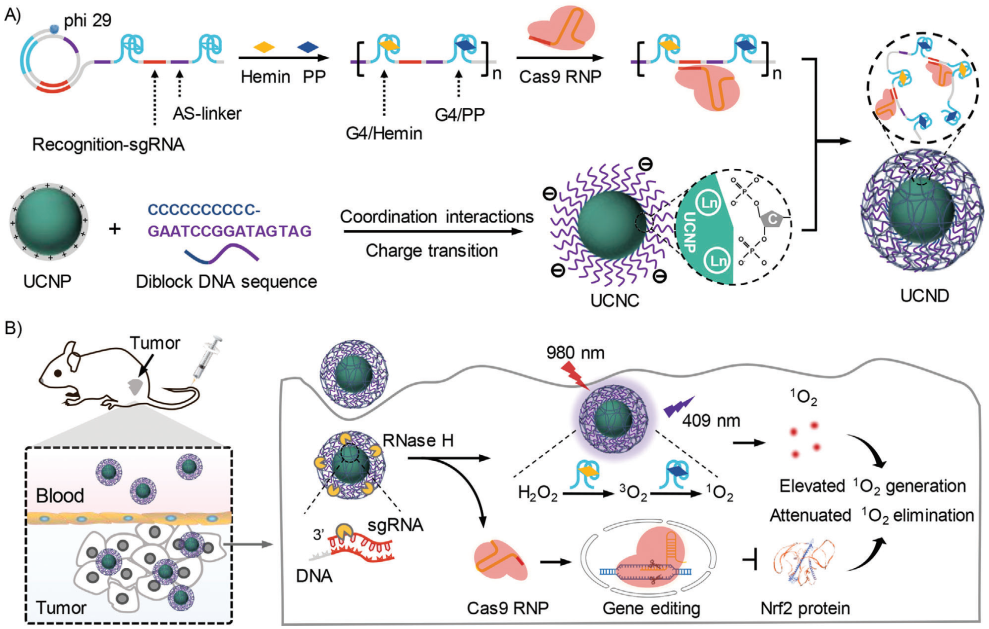
光动力疗法(PDT)需要通过光照射激发光敏剂(PS)以产生活性氧(ROS),其在肿瘤微环境乏氧、癌细胞的抗氧化反应以及光对组织的穿透性有限等方面仍面临着严峻的挑战。有鉴于此,天津大学姚池教授、仰大勇教授和上海交通大学刘培峰教授开发了一种多功能DNA/上转换纳米颗粒(UCNPs)复合物,该复合物能够可控地共递送CRISPR-Cas9、血红素和原卟啉(PP),以实现协同PDT。
本文要点:
(1)实验通过滚环扩增(RCA)技术制备了超长单链DNA(ssDNA),其中包含用于负载Cas9核糖核蛋白(RNP)的单向导RNA(sgRNA)识别序列、用于负载hemin和PP的G-四联体序列以及用于结合UCNP的连接序列。研究发现,Cas9 RNP能够切割抗氧化调节器核因子E2相关因子2(Nrf2),提高癌细胞对ROS的敏感性,从而增强协同PDT效应。
(2)G-四联体/血红素DNA酶能够模拟辣根过氧化物酶(HRP)活性,催化内源性H2O2转化为O2,以克服肿瘤的乏氧微环境。此外,引入的UCNP也能够将穿透深层组织的近红外光转换为波长较短的光,从而激发PP将丰富的O2转化为1O2。基因编辑和PDT的联合作用能够使得癌细胞中大量积累1O2,从而显著增强癌细胞凋亡。实验结果表明,该研究设计的协同PDT策略能够在乳腺癌小鼠模型中表现出显著的治疗效果。
Nachuan Song. et al. A DNA/Upconversion Nanoparticle Complex Enables Controlled Co-Delivery of CRISPR-Cas9 and Photodynamic Agents for Synergistic Cancer Therapy. Advanced Materials. 2024
DOI: 10.1002/adma.202309534
https://onlinelibrary.wiley.com/doi/10.1002/adma.202309534



















