
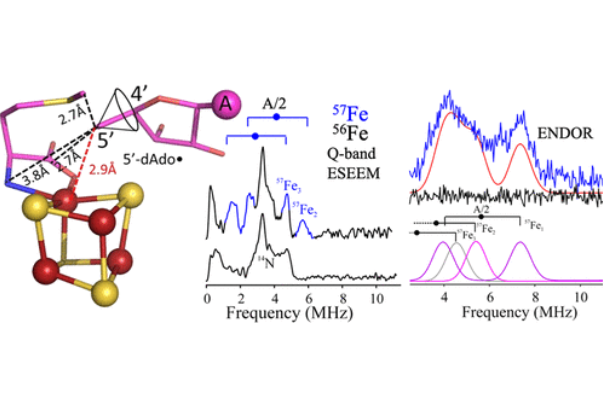
S-腺苷-l-甲硫氨酸(SAM)自由基、丙酮酸甲酸裂解酶活化酶(PFL-AE)的活性位点内捕获的5′-脱氧腺苷(5′-dAdo)自由基的2H和13C超精细偶联常数完全是经典有机自由基的特征,其未配对电子位于sp2 C5′-碳的2pπ轨道中。然而,先前的电子-核双共振(ENDOR)测量表明,这种5′-dAdo自由基从未真正“自由”:与目标伴侣和活性位点残基的紧密范德华接触引导它进行极其精确的区域选择性反应,这是RS酶的标志。
西北大学Brian M. Hoffman和Joan B. Broderick等对活性位点伴侣5′-dAdo如何在簇结合SAM的同裂过程中与5′-dAdo共产生的相邻同位素标记的甲硫氨酸结合的[4Fe–4S]2+簇进行显著的57Fe、13C、15N和2H超精细偶联的发现,扩展了我们对活性位点伴侣5′-dAdo的理解。
本文要点:
(1)
通过非成键自由基-团簇接触的57Fe耦合的起源由形式交换耦合模型和对称性破缺-密度泛函理论计算阐明。将内啡肽衍生的C5′(dAdo)到标记蛋氨酸的距离作为结构约束条件,产生了一个5′-dAdo活性位点定位模型,该模型具有较短的非结合C5′-Fe距离。
(2)
该距离涉及S–C(5′)键断裂时5′-dAdo向[4Fe–4S]2+团簇的独特Fe的实质性移动,这似乎是有机金属配合物Fe–C5′键形成的第一步。
参考文献:
Hao Yang, Madeline B. Ho, Maike N. Lundahl, Martín A. Mosquera, William E. Broderick, Joan B. Broderick*, and Brian M. Hoffman*, ENDOR Spectroscopy Reveals the “Free” 5′-Deoxyadenosyl Radical in a Radical SAM Enzyme Active Site Actually is Chaperoned by Close Interaction with the Methionine-Bound [4Fe–4S]2+ Cluster. J. Am. Chem. Soc. 2024, XXXX, XXX, XXX-XXX
DOI: 10.1021/jacs.3c09428
https://doi.org/10.1021/jacs.3c09428


















