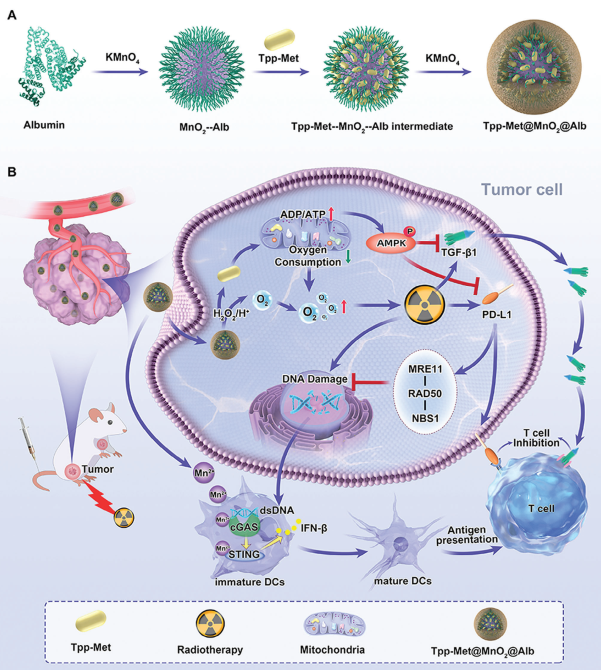
由于存在乏氧条件下的DNA损伤减少以及转化生长因子-β1(TGF-β1)和膜定位的程序性死亡配体-1(PD-L1)触发的获得性免疫耐受等问题,部分肿瘤患者会表现出对放疗的耐药性。与此同时,在胞质中分布的PD-L1也可通过加速DNA损伤修复(DDR)诱导产生放疗耐药。然而,目前临床使用的PD-L1抗体往往无法抑制胞质分布的PD-L1,使其有效性会受到很大的限制。有鉴于此,中南大学李源教授、温州医科大学沈建良教授和Zaigang Zhou开发了一种纳米佐剂(Tpp-Met@MnO2@Alb),其能够通过多水平免疫激活增强肿瘤对放疗的敏感性。
本文要点:
(1)Tpp-Met@MnO2@Alb的治疗机制包括利用三苯基膦衍生的二甲双胍抑制PD-L1和TGF-β1以及通过MnO2生成Mn2+以激活cGAS-STING通路,并通过逆转肿瘤乏氧和破坏DDR以产生更多的dsDNA。
(2)实验结果表明,Tpp-Met@MnO2@Alb能够有效地提高放疗的效率,抑制受照射的局部和远端肿瘤的进展和肿瘤肺转移,并且可以诱导长期的抗肿瘤免疫记忆,而不会产生显著的副作用。综上所述,该研究构建的Tpp-Met@MnO2@Alb具有克服临床放射-免疫治疗耐药性的重要潜力。
Lei Yi. et al. A Hybrid Nanoadjuvant Simultaneously Depresses PD-L1/TGF-β1 and Activates cGAS-STING Pathway to Overcome Radio-Immunotherapy Resistance. Advanced Materials. 2024
DOI: 10.1002/adma.202304328
https://onlinelibrary.wiley.com/doi/10.1002/adma.202304328



















