虽然已知蛋白形式多样性具有高度的生物学相关性,但目前的蛋白质分析方法在区分蛋白形式方面的用途有限。特别是质谱法,通常只提供关于翻译后修饰位点的模糊信息,并且无法解析共存修饰的序列。近日,代尔夫特理工大学Chirlmin Joo报道了基于荧光共振能量转移(FRET)的单分子蛋白质指纹图谱,以绘制单个全长蛋白质分子中单个氨基酸的位置和翻译后修饰。
虽然已知蛋白形式多样性具有高度的生物学相关性,但目前的蛋白质分析方法在区分蛋白形式方面的用途有限。特别是质谱法,通常只提供关于翻译后修饰位点的模糊信息,并且无法解析共存修饰的序列。近日,代尔夫特理工大学Chirlmin Joo报道了基于荧光共振能量转移(FRET)的单分子蛋白质指纹图谱,以绘制单个全长蛋白质分子中单个氨基酸的位置和翻译后修饰。
本文要点:
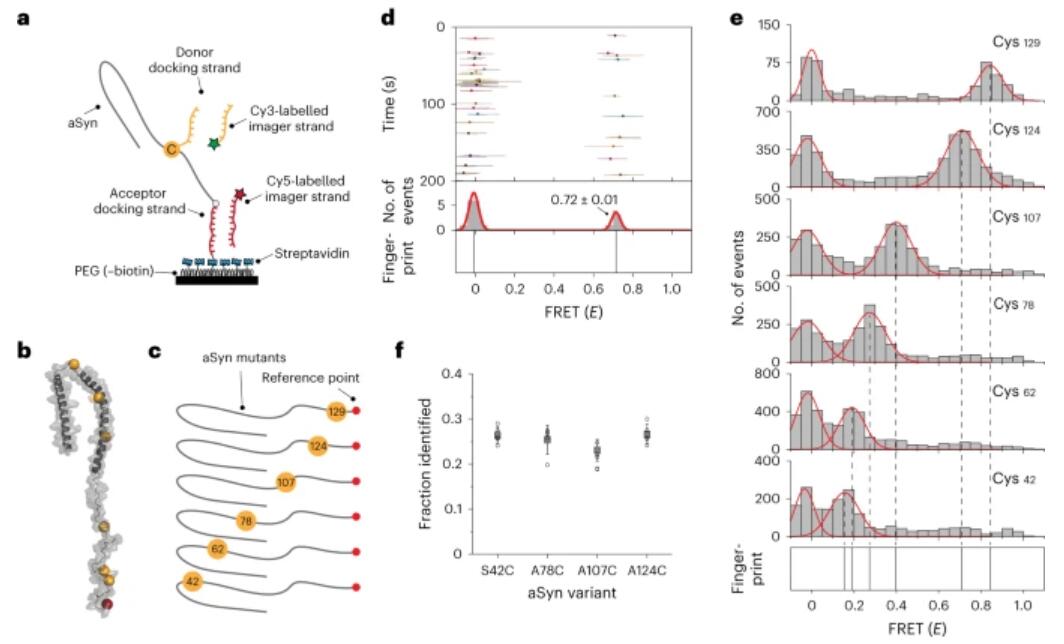
1) 数据表明,本质无序的蛋白质和折叠的球状蛋白质都可以以亚纳米级的分辨率进行指纹识别,通过DNA交换和使用单分子FRET逐个探测氨基酸来实现。通过分析α-突触核蛋白(一种内在无序的蛋白质),作者使用机器学习分类器准确量化混合物中的异构体,并确定两个O-GlcNAc结构的位置。
2) 此外,作者证明了球状蛋白Bcl-2样蛋白1、降钙素原和S100A9的指纹图谱。这种以最高灵敏度进行蛋白形式鉴定的能力在蛋白质组学研究和基于生物标志物的诊断中极具应用前景。
Mike Filius et.al Full-length single-molecule protein fingerprinting Nature Nanotechnology 2024
DOI: 10.1038/s41565-023-01598-7
https://doi.org/10.1038/s41565-023-01598-7