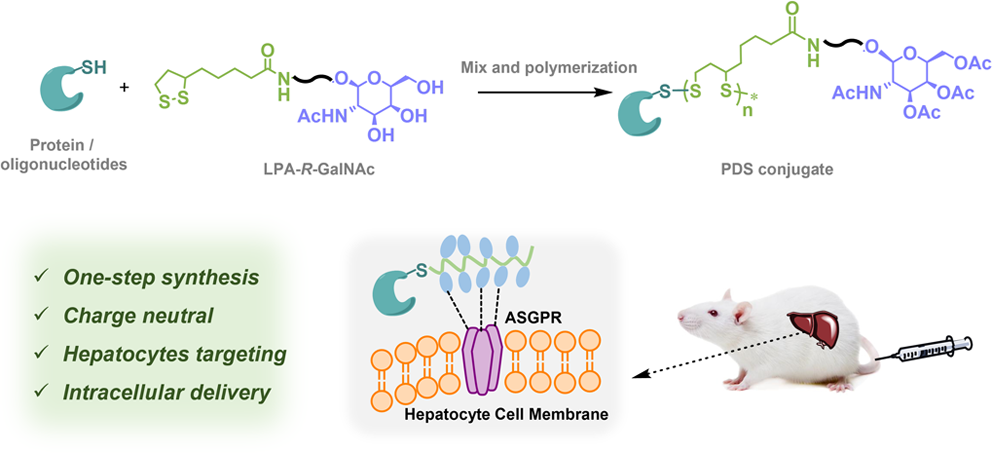
通过全身给药实现生物制剂(包括蛋白质和反义寡核苷酸(ASO))在特定器官或细胞内的胞内递送是一项亟待攻克的难题。有鉴于此,北京大学吕华研究员利用N-乙酰化半乳糖胺(GalNAc)功能化、细胞穿透性聚二硫化物(PDSs)偶联物设计了一种能够在体外和体内将蛋白质和ASO递送到肝细胞的新方法。
本文要点:
(1)含硫醇的载荷可通过聚集诱导聚合实现GalNAc功能化的硫辛酰胺单体的开环聚合,从而形成准均匀分散的位点特异性蛋白/ASO-PDS偶联物。研究发现,该偶联物的肝细胞选择性胞内递送功能是多种因素共同作用的结果。其中,GalNAc会首先与肝细胞上的ASGPR受体结合,从而导致细胞固定化。随后,在细胞表面发生的硫醇-二硫键交换能够促进细胞内化。
(2)实验结果表明,PDS骨架与细胞表面之间的紧密距离具有非常重要的作用,其能够决定硫醇-二硫键交换的成功,从而影响细胞穿透。综上所述,该研究构建的偶联物有望能够克服全身和细胞特异性生物大分子物质递送过程中遇到的多种生物障碍,从而为一系列设计靶向肝脏疾病的诊疗策略开辟了新的途径。
Jianhua Lu. et al. Organ/Cell-Selective Intracellular Delivery of Biologics via N‑Acetylated Galactosamine-Functionalized Polydisulfide Conjugates. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.3c11914
https://pubs.acs.org/doi/10.1021/jacs.3c11914



















