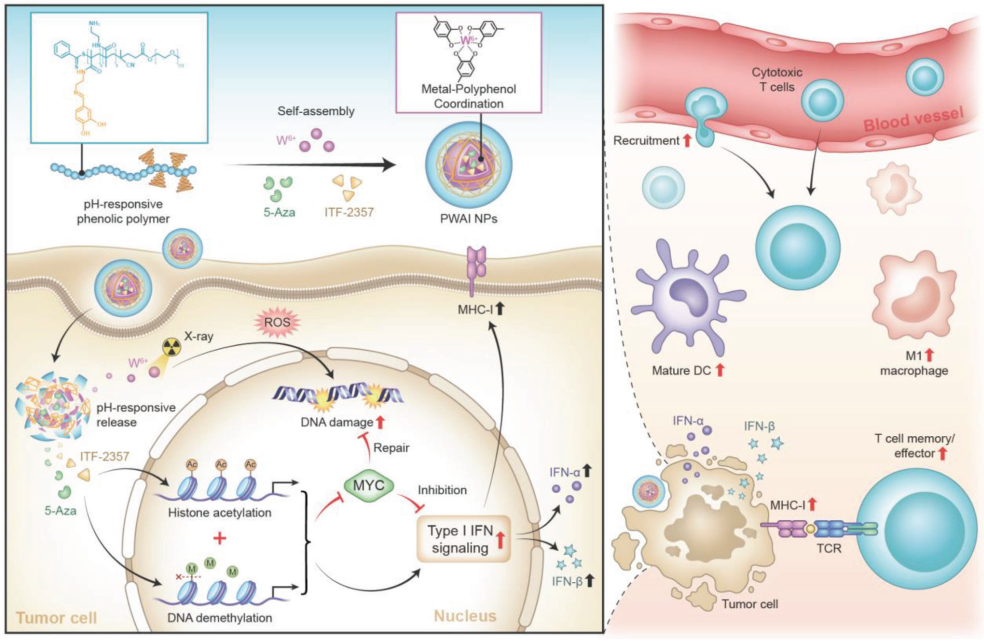
癌细胞可通过上调MYC的表达来修复放疗引发的DNA损伤,进而加重治疗耐药性和肿瘤免疫抑制。以MYC转录异常为靶点的表观遗传学治疗有望能够解决这一临床问题。有鉴于此,澳门大学代云路教授和李蓓教授将5-Aza(DNA甲基转移酶抑制剂)和ITF-2357(组蛋白去乙酰化酶抑制剂)设计成钨基纳米放疗增敏剂(PWAI),以抑制MYC的上调,从而诱导产生强大的放疗抗肿瘤免疫。
本文要点:
(1)单独的5-Aza能够减少MYC的表达,但无法有效唤醒放疗免疫。而引入的ITF-2357则可以触发癌细胞I型干扰素(IFN-I)信号传导,从而克服这一缺陷。研究发现,5-Aza与ITF-2357的偶联能够确保PWAI在增强放射治疗肿瘤杀伤作用的同时不会引起与MYC相关的高度免疫抵抗,并且能够促进IFN-I信号相关蛋白(IFN-α和IFN-β)的产生。
(2)与单纯放疗不同的是,PWAI诱导的免疫-放射治疗可以显著增强4T1荷瘤小鼠体内树突状细胞的肿瘤抗原提呈,并促进肿瘤内细胞毒性T淋巴细胞的募集及其记忆表型的形成。综上所述,该研究证明了双重表观遗传重编程策略能够降低放疗诱导的MYC过表达,进而可以实现良好的免疫-放射治疗效果。
Guohao Wang. et al. Dual-Epigenetically Relieving the MYC-Correlated Immunosuppression via an Advanced Nano-Radiosensitizer Potentiates Cancer Immuno-Radiotherapy. Advanced Materials. 2024
DOI: 10.1002/adma.202312588
https://onlinelibrary.wiley.com/doi/10.1002/adma.202312588



















