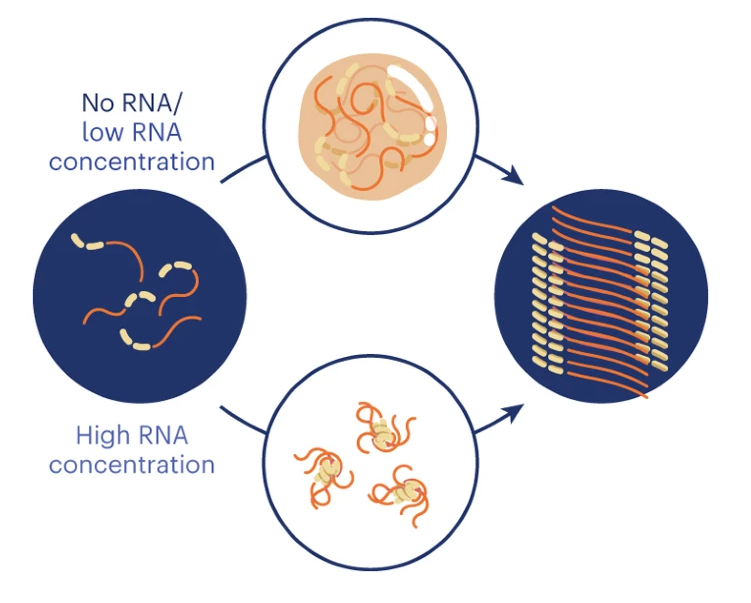
人们发现无膜细胞器的多种RNA结合的蛋白能够形成与退行性疾病有关的病理性淀粉蛋白,但是目前对这种团聚结构的调节机制并不清楚。
有鉴于此,苏黎世联邦理工学院Paolo Arosio等研究了蛋白-RNA相互作用如何能够调节hnRNPA1A(肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS),也叫做运动神经元病)的蛋白如何形成凝聚结构以及从液体转变为淀粉状结构。
参考文献
Morelli, C., Faltova, L., Capasso Palmiero, U. et al. RNA modulates hnRNPA1A amyloid formation mediated by biomolecular condensates. Nat. Chem. (2024)
DOI: 10.1038/s41557-024-01467-3