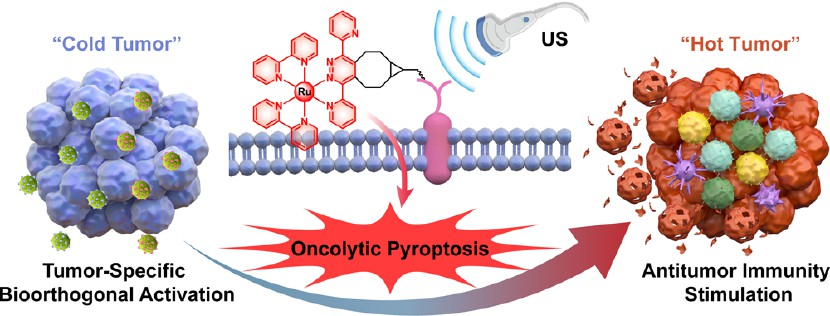
个性化原位肿瘤疫苗是一种极具发展前景的免疫治疗方法。然而,利用免疫原性细胞死亡(ICD)来制备原位肿瘤疫苗的策略仍会受到免疫原性不足和免疫抑制性肿瘤微环境(TME)等问题的影响。有鉴于此,中国科学院深圳先进技术研究院蔡林涛研究员、李文军研究员和深圳技术大学设计潘正银教授设计并筛选了一系列四嗪功能化的钌(II)声敏剂,并将其用于通过诱导溶瘤细胞焦亡来建立生物正交激活的原位肿瘤疫苗。
本文要点:
(1)基于纳米递送增强的生物正交糖代谢工程能够对肿瘤进行选择性重塑,进而将人工靶点双环[6.1.0]壬炔(BCN)引入细胞膜中。通过与肿瘤内的BCN受体发生特异性生物正交连接,该声敏剂可以在肿瘤部位实现精准的膜锚定和同步点击激活。在超声的激发作用下,活化的声敏剂能够通过产生I/II型活性氧(ROS)以显著破坏细胞膜,从而实现高效的声动力治疗(SDT)。
(2)实验结果表明,严重的膜损伤可显著诱导溶瘤性细胞焦亡,以实现肿瘤免疫原性的最大化,并逆转免疫抑制性TME,从而产生强大且持久的全身抗肿瘤免疫应答。在"冷"肿瘤模型中,US诱导的细胞焦亡可以有效抑制原发和远端肿瘤的生长,并抑制肿瘤的转移和复发。综上所述,该研究设计的由生物正交驱动的肿瘤特异性焦亡诱导策略在开发强效的原位肿瘤疫苗方面具有广阔的应用前景。
Xiaoyu Xu. et al. Bioorthogonal/Ultrasound Activated Oncolytic Pyroptosis Amplifies In Situ Tumor Vaccination for Boosting Antitumor Immunity. ACS Nano. 2024
DOI: 10.1021/acsnano.3c11023
https://pubs.acs.org/doi/10.1021/acsnano.3c11023



















