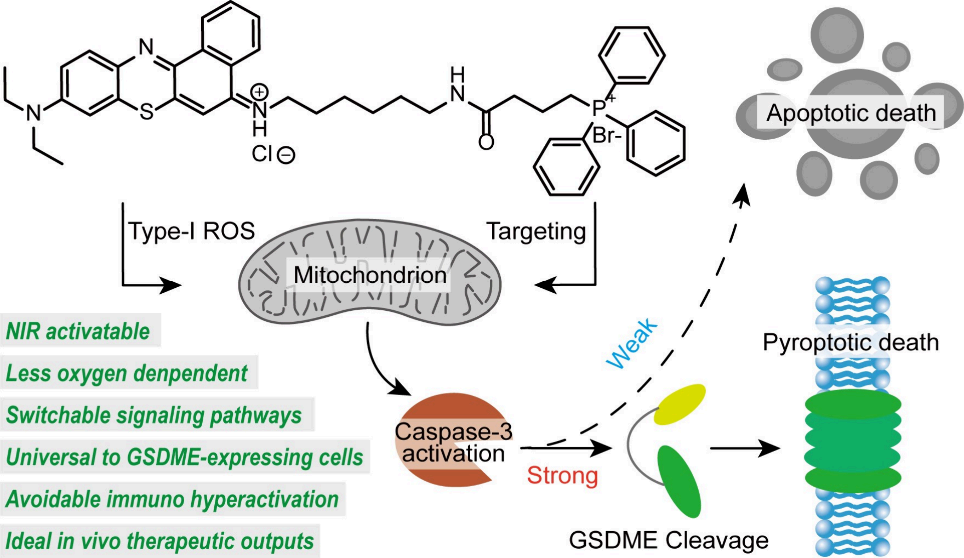
在程序性细胞死亡过程中精确地控制细胞信号事件具有重要的意义,也是癌症治疗面临的一项严峻挑战。由于缺乏高效、生物相容性和时空可控的方法,因此如何对肿瘤细胞中的信号转导进行调控仍是一个亟待攻克的难题。有鉴于此,新加坡国立大学刘小钢教授、复旦大学步文博教授和香港城市大学李振声教授设计了一种光动力策略,其可通过改变caspase-3蛋白活性和相关的信号交流来调节凋亡型和焦亡型细胞死亡。
本文要点:
(1)该策略采用了靶向线粒体的近红外激活探针(M-TOP),该探针可通过I型光化学机制发挥作用。M-TOP对氧的依赖性较低,其即使在乏氧的条件下也能有效地治疗耐药癌细胞。研究发现,较高剂量的M-TOP可通过caspase-3/gasdermin-E通路诱导焦亡型细胞死亡,而较低剂量的M-TOP则会导致细胞凋亡。
(2)这种光动力治疗策略对多种表达gasdermin-E的癌细胞有效。实验结果表明,M-TOP介导的从凋亡到焦亡调节的转变能够引起可控的炎症反应,进而产生强效且平衡的免疫应答,以有效地抑制远端肿瘤的生长和术后肿瘤的复发。综上所述,该研究工作证明了通过合理设计光动力抗癌药物能够实现对细胞内信号的有效调节。
Zhigao Yi. et al. Mitochondria-Targeting Type‑I Photodrug: Harnessing Caspase‑3 Activity for Pyroptotic Oncotherapy. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c01929
https://pubs.acs.org/doi/10.1021/jacs.4c01929



















