活性氧(ROS)的产生不足和肿瘤的放疗耐药性是导致放疗(RT)失败的主要原因。有鉴于此,吉林大学王铁君教授开发了一种能够激活ROS诱导的细胞凋亡和铁死亡的生物材料,并将其用于提高肿瘤对放疗的敏感性。
本文要点:
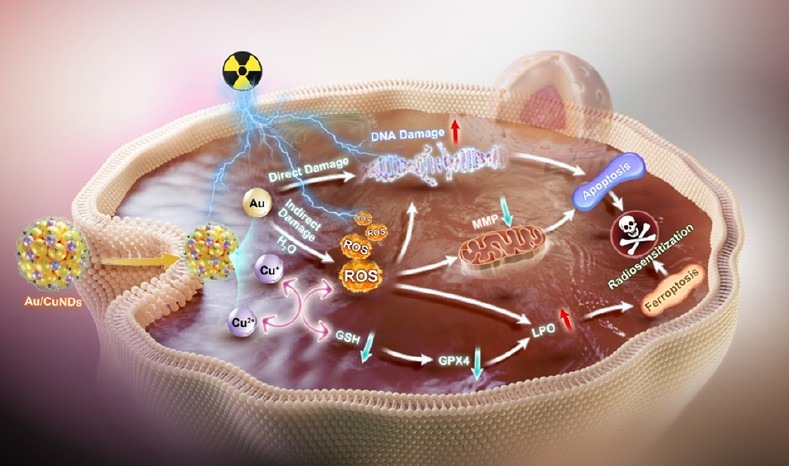
(1)为了实现精准高效的RT,实验设计了一种诊疗纳米平台Au/Cu纳米点(Au/CuNDs),以用于双模态成像、放大ROS的生成和诱导细胞凋亡-铁死亡,从而实现RT增敏。研究发现,大量产生的ROS来源于三个方面:(1)当暴露于电离辐射时,Au/CuNDs可有效地吸收光子并发射电子,这些电子可与水发生相互作用以产生ROS;(2)作为纳米酶的Au/CuNDs可通过与肿瘤细胞过表达的过氧化氢发生类芬顿反应以产生大量ROS;(3)Au/CuNDs可消耗过表达的谷胱甘肽,进而增强ROS的积累。
(2)大量的ROS和电离辐射可通过增加DNA损伤以进一步导致细胞凋亡,并通过增强脂质过氧化作用导致铁死亡,从而显著提高RT的治疗效率。实验结果表明,Au/CuNDs是一种性能优异的纳米探针,可实现肿瘤的高分辨近红外荧光成像和计算机断层扫描成像。综上所述,该研究开发的诊疗纳米平台具有双模态成像的功能,并可通过ROS激活的细胞凋亡-铁死亡实现放疗增敏,其在癌症的临床诊断和治疗应用等方面具有良好的应用前景。
Ze Wang. et al. Reactive Oxygen Species Amplifier for Apoptosis Ferroptosis Mediated High-Efficiency Radiosensitization of Tumors. ACS Nano. 2024
DOI: 10.1021/acsnano.4c01625
https://pubs.acs.org/doi/10.1021/acsnano.4c01625



















