
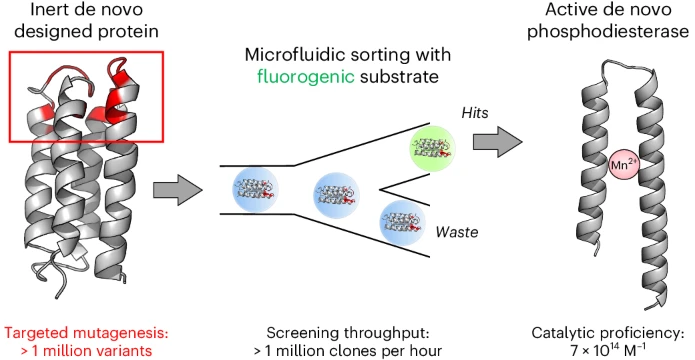
如何从未进化的氨基酸序列形成生物催化剂是地球上产生生命的关键。在数十亿年的演变过程中,早期的结构与现代酶的结构之间显著区别。
有鉴于此,普林斯顿大学Michael H. Hecht、剑桥大学Florian Hollfelder等通过高通量液体微流体技术,从超过一百万个序列的氨基酸数据库内进行筛选,提出可能具有活性的磷酸酯酶。
参考文献
Schnettler, J.D., Wang, M.S., Gantz, M. et al. Selection of a promiscuous minimalist cAMP phosphodiesterase from a library of de novo designed proteins. Nat. Chem. (2024).
DOI: 10.1038/s41557-024-01490-4
https://www.nature.com/articles/s41557-024-01490-4


















