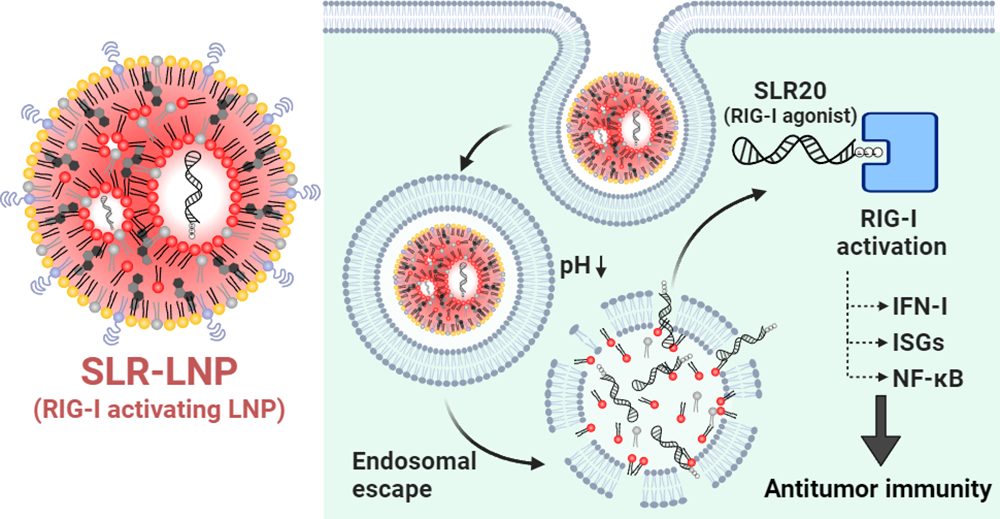
药理性激活维甲酸诱导基因I(RIG-I)通路有望能够提高肿瘤的免疫原性,并改善免疫检查点抑制剂(ICIs)产生的免疫应答。然而,RIG-I的5'-三磷酸RNA(3pRNA)激动剂的临床疗效仍会受到多种药理学障碍(药代动力学差、核酸酶降解以及无法被有效递送到RIG-I所在的细胞质中)的影响。有鉴于此,范德堡大学John T. Wilson通过利用可电离脂质纳米颗粒(LNPs)递送3p修饰的茎-环RNA(SLRs)来解决上述问题。
本文要点:
(1)实验通过将SLRs封装进LNPs构建了粒径约为100纳米、表面电荷中性的纳米颗粒SLR-LNPs,其可在体内外有效激活RIG-I信号通路。研究发现,通过瘤内注射和静脉注射等途径给药的SLR-LNPs可在肿瘤微环境(TME)中激活RIG-I,并且能够在免疫原性较差的黑色素瘤和乳腺癌小鼠模型中抑制肿瘤的生长。
(2)在原位三阴性乳腺癌EO771模型中,全身给药的SLR-LNPs可重编程乳腺癌TME,以增强具有抗肿瘤功能的CD8+和CD4+ T细胞的浸润,改善αPD-1 ICI诱导的免疫反应。研究者也在转移性B16模型中进一步证实了SLR-LNPs的治疗效果。在F10黑色素瘤模型中,与αPD-1 + αCTLA-4联合ICI相比,全身给药的SLR-LNPs可显著降低肺转移负荷。综上所述,该研究构建的SLR-LNPs是一种具有转化前景的免疫治疗纳米药物,可有效、选择性地激活RIG-I,从而能够增强ICI和其他免疫治疗模式诱导的抗肿瘤免疫应答。
Lihong Wang-Bishop. et al. Nanoparticle Retinoic Acid-Inducible Gene I Agonist for Cancer Immunotherapy. ACS Nano. 2024
DOI: 10.1021/acsnano.3c06225
https://pubs.acs.org/doi/10.1021/acsnano.3c06225



















