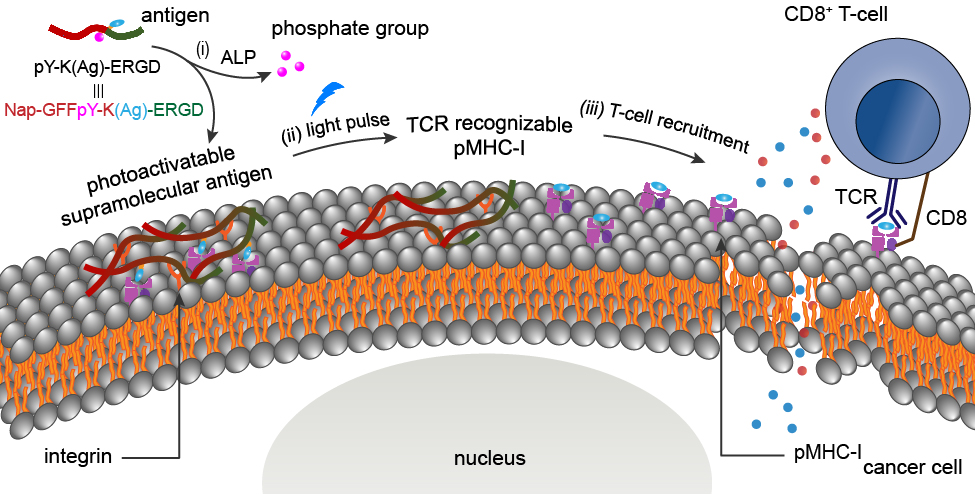
基于细胞毒性CD8+ T淋巴细胞(CTLs)的肿瘤免疫疗法在肿瘤治疗领域中具有广阔的应用前景。T细胞受体与肿瘤细胞膜上的肽-MHC-I复合物(pMHC-I)之间的特异性相互作用会显著影响CTLs的治疗效果。然而,用于MHC-I呈递的合适内源性抗原的缺乏会导致CTLs无法识别肿瘤。有鉴于此,温州医科大学沈贤教授、Zhi-Wen Hu和南开大学杨志谋教授设计了三种负载抗原的自组装多肽(pY-K(Ag)-ERGD,pY-K(Ag)-E和Y-K(Ag)-ERGD),它们能够以不同的方式在肿瘤部位非共价生成光激活的超分子抗原,并证明了pY-K(Ag)-ERGD可以按需赋予肿瘤细胞pMHC-I靶点。
本文要点:
(1)pY-K(Ag)-ERGD会首先在癌细胞膜上产生低抗原性超分子抗原。研究发现,连续的光脉冲会使抗原有效载荷从超分子支架中被有效释放,以直接产生抗原性pMHC-I。
(2)实验结果表明,将静脉注射pY-K(Ag)-ERGD与过继转移的抗原特异性CLT相结合的策略能够实现对肿瘤的光控生长抑制。综上所述,该研究进一步拓展了用于T细胞免疫治疗的肿瘤抗原库,为实现精准可控的T细胞免疫治疗开辟了一条新的途径。
Yinghao Ding. et al. Enzyme-Instructed Photoactivatable Supramolecular Antigens on Cancer Cell Membranes for Precision-Controlled T‑Cell-Based Cancer Immunotherapy. Nano Letters. 2024
DOI: 10.1021/acs.nanolett.4c01587
https://onlinelibrary.wiley.com/doi/10.1002/anie.202406602



















