
丰富的天然胶原蛋白能够形成杂三聚体三螺旋(heterotrimeric triple helices),人们研究发现胶原蛋白类似物的合成非常缓慢,甚至比同三聚体螺旋更加缓慢。人们对于折叠非常缓慢的原因仍并不清楚。
有鉴于此,莱斯大学Jeffrey D. Hartgerink等报道通过计算辅助方法比较三个杂三聚体三螺旋类似物的稳定性、特异性、折叠速度。
本文要点
(1)
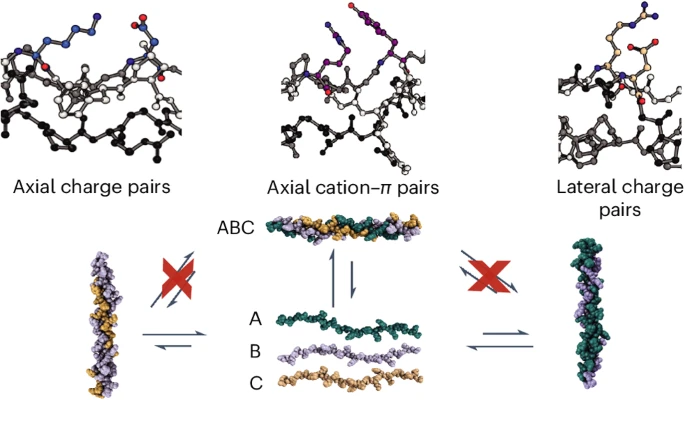
研究ABC形式的杂三聚体晶体结构,发现组成受到非常好的控制,而且说明组装体内的离子-π成对相互作用以及轴向或纵向盐桥的结构。胶原蛋白杂三聚体的折叠速度能够比设计完好的体系更快,通过圆二色谱表征以及核磁表征,发现非有效性或者竞争性杂三聚体物种能够阻碍形成折叠结构,而且这种折叠结构需要重新打开才可以重新折叠形成热力学稳定的组装结构。
(2)
通过事先引入竞争性的三螺旋结构能够阻碍这种异三聚体胶原蛋白的折叠速率,这个现象说明杂三聚体折叠动力学非常缓慢主要因为热力学具有优势的竞争性三螺旋结构导致。
参考文献
Cole, C.C., Walker, D.R., Hulgan, S.A.H. et al. Heterotrimeric collagen helix with high specificity of assembly results in a rapid rate of folding. Nat. Chem. (2024).
DOI: 10.1038/s41557-024-01573-2
https://www.nature.com/articles/s41560-024-01567-x


















