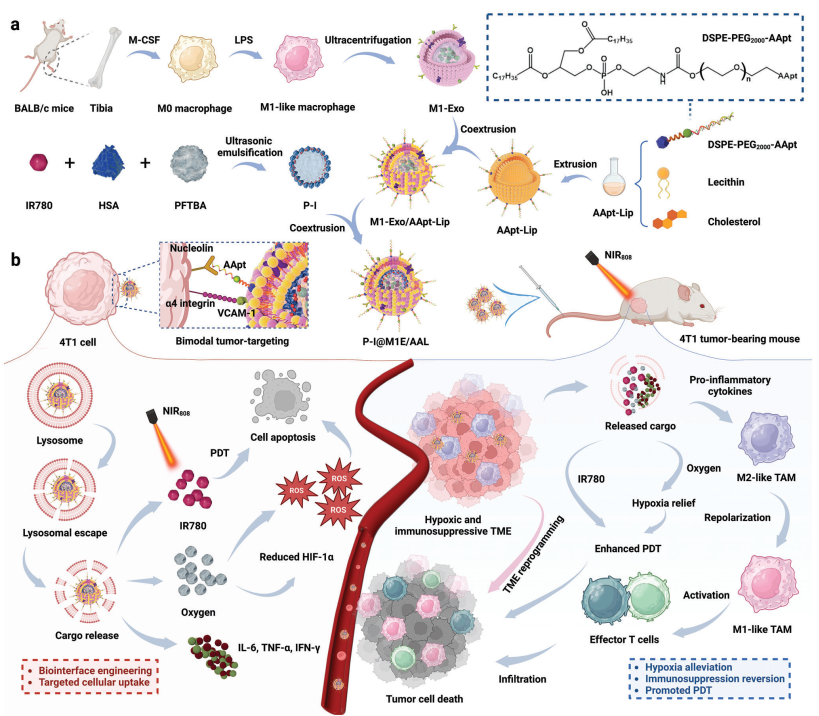
多种类型的肿瘤(如三阴性乳腺癌)的肿瘤微环境(tumor microenvironment,TME)具有乏氧、免疫抑制和丰富的肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)等特点,这些特点也能够作为抗肿瘤治疗的潜在靶点。类M1巨噬细胞源性外泌体(M1-Exos)具有靶向肿瘤和巨噬细胞极化等能力,是一种极具发展前景的肿瘤治疗药物。然而,M1-Exos的载药效率和稳定性仍较为有限,导致其在抗肿瘤应用中的有效性受到了严重阻碍。有鉴于此,西安交通大学王嗣岑教授、解笑瑜教授和哈佛大学医学院陶伟教授通过将M1-Exos与AS1411适配体结合的脂质体(AApt-Lips)进行集成,开发了一种杂化纳米囊泡(M1E/AALs)。
本文要点:
(1)实验利用M1E/AALs负载全氟三丁胺(PFTBA)和IR780(即P-I),构建了P-I@M1E/AALs,其可通过缓解肿瘤乏氧和工程化TAMs实现TME重编程。P-I@M1E/AALs介导的肿瘤治疗能够增强活性氧的原位生成,使TAMs向抗肿瘤表型复极化,并促进T淋巴细胞的浸润。研究发现,基于P-I@M1E/AALs的协同抗肿瘤治疗能够显著抑制4T1荷瘤小鼠的肿瘤生长,以延长其生存期。
(2)实验结果表明,P-I@M1E/AAL纳米平台可通过集成多种治疗模式实现对TAM的靶向重编程和增强的肿瘤光动力-免疫治疗,进而能够为克服乏氧、免疫抑制性TME提供一种有效的策略。综上所述,该研究工作开发了一种新型的杂化纳米囊泡平台,可用于治疗具有乏氧、免疫抑制性TME的肿瘤。
Xueyan Zhen. et al. Biointerface-Engineered Hybrid Nanovesicles for Targeted Reprogramming of Tumor Microenvironment. Advanced Materials. 2024
DOI: 10.1002/adma.202401495
https://onlinelibrary.wiley.com/doi/10.1002/adma.202401495



















