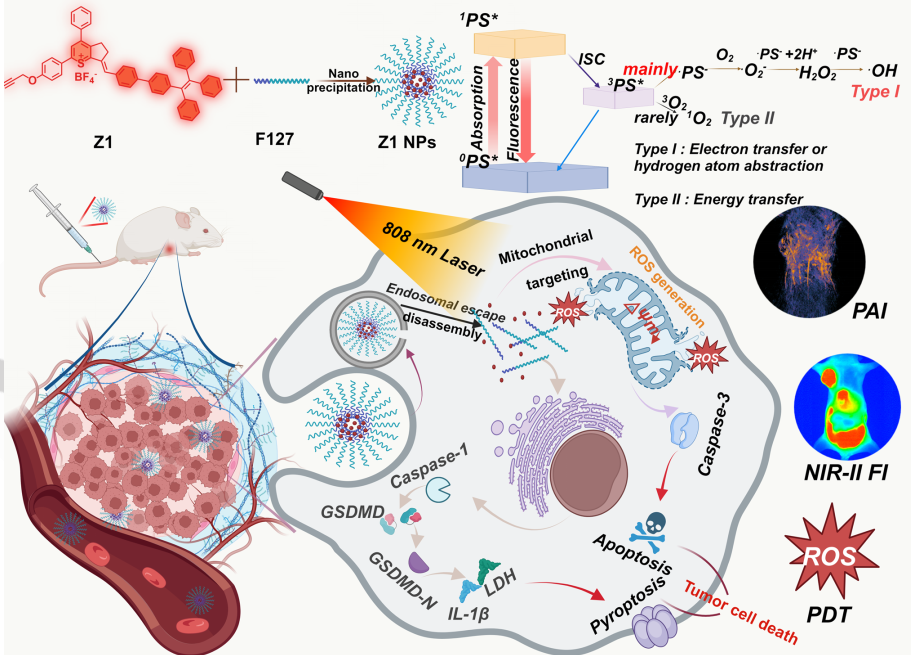
克服肿瘤细胞的凋亡抗性是提高肿瘤治疗效果的关键。细胞焦亡是程序性细胞死亡(PCD)的一种裂解形式,其涉及炎性小体、Gasdermin家族蛋白和半胱氨酸蛋白酶,在癌症治疗领域中具有重要价值。虽然光动力疗法(PDT)可以通过激活光敏剂(PSs)产生活性氧(ROS)来诱导细胞焦亡,但目前许多PSs仍缺乏特异性亚细胞靶点,且局限于近红外一区,导致其治疗效果受限。因此,开发有效、可深度穿透、以细胞器为靶点、细胞焦亡介导的光学治疗对于癌症治疗而言至关重要。有鉴于此,南京邮电大学范曲立教授、尹超教授和Hui Zhou合成了4种具有不同苯环数的噻吩结构分子,并探讨了它们的光动力性能。
本文要点:
(1)具有较高苯环数量的近红外二区(NIR-II)PS Z1能够表现出更强的ROS生成和线粒体靶向能力,并且Stokes位移较大。研究发现,通过纳米沉淀方法构建的Z1纳米颗粒(NPs)可在808 nm激光照射下产生高水平的ROS(尤其是I型ROS),以实现有效的线粒体功能障碍和细胞焦亡-凋亡的结合。
(2)研究者通过NIR-II荧光成像(NIR-II FI)和光声成像(PAI)证明了Z1 NPs能够表现出优异的肿瘤靶向能力。实验结果表明,Z1 NPs介导的光学治疗可有效抑制肿瘤生长,并且不会产生显著的不良反应。综上所述,该研究开发了一种具有临床转化前景的肿瘤治疗新策略。
Ben Wang. et al. A Mitochondria-Targeted Photosensitizer for Combined Pyroptosis and Apoptosis with NIR-II Imaging/Photoacoustic Imaging-Guided Phototherapy. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202408874
https://onlinelibrary.wiley.com/doi/10.1002/anie.202408874



















