
开发形成C-C化学键并且控制立体选择性对于合成复杂结构分子的方法非常重要,在各种方法中,交叉偶联反应是最有效并且应用最广泛的方法,而且最近人们能够在合成过程中产生手性,因此进一步改善交叉偶联反应方法。砜类化合物(Sulfones)是重要的有机亲电试剂,并且作为交叉偶联试剂具有许多优势。但是自从1979年砜类分子被发现,目前仍没有能够立体选择性或者立体汇聚的交叉偶联反应。砜类官能团具有较高的酸性,因此人们并不知道,砜是否能够应用于三级碳之外的反应。
有鉴于此,加拿大女王大学Cathleen M. Crudden、名古屋大学Masakazu Nambo等报道砜类化合物和格氏试剂之间的立体选择性交叉偶联。
本文要点
(1)
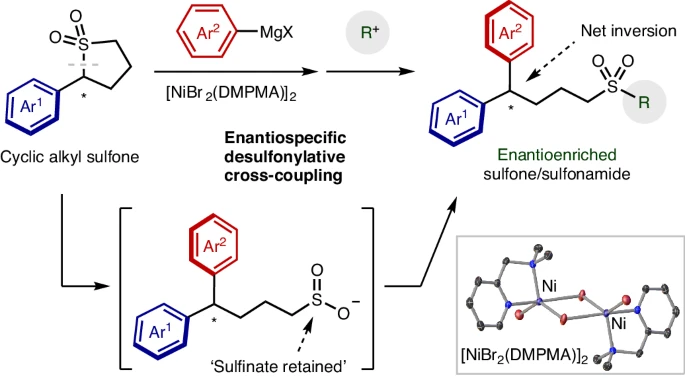
该反应使用强碱性的格氏试剂,但是能够实现99 %的手性转移。通过原位观测实验说明交叉偶联反应比动力学竞争反应(去质子化反应)更有优势,因此交叉偶联反应过程中得到优异的立体选择性。
(2)
开发了立体选择性的Ni催化Kumada–Tamao–Corriu偶联反应。该体系与以往发展的方法具有明显优势,反应后保留了砜结构,能够进一步进行官能团转化。砜类结构或磺胺在药物、农药、聚合物、有机电子材料等领域的应用非常广泛,通过这种交叉偶联反应引入砜官能团具有非常重要的意义。
参考文献
Nolla-Saltiel, R., Ariki, Z.T., Schiele, S. et al. Enantiospecific cross-coupling of cyclic alkyl sulfones. Nat. Chem. (2024).
DOI: 10.1038/s41557-024-01594-x


















