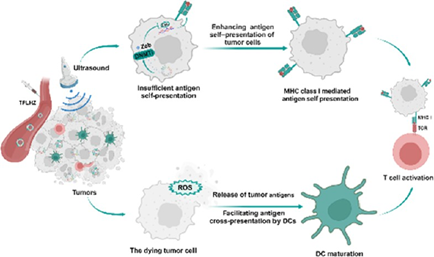
肿瘤细胞抗原的自呈递不足和树突状细胞(DCs)的抗原交叉呈递无效等问题会导致免疫识别和激活减弱,进而产生免疫治疗耐药性。有鉴于此,河南工业大学张贝贝教授利用由类囊体(TK)/血小板(PLT)膜和包裹DNA甲基转移酶抑制剂泽布拉林(Zeb)和声敏剂血卟啉单甲醚(HMME)的脂质体组成的杂化纳米囊泡构建了一种超声激活的原位疫苗。
本文要点:
(1)在局部超声辐照下,该原位疫苗能够产生活性氧(ROS),并诱导有效载荷的连续释放。研究发现,Zeb可有效抑制肿瘤DNA超甲基化,促进主要组织相容性复合体I类(MHC-I)分子介导的抗原自呈递,以提高免疫识别。
(2)与此同时,TK膜上的过氧化氢酶可将肿瘤过表达的H2O2分解为O2,从而促进ROS的产生,以破坏肿瘤细胞,实现抗原的原位释放和DCs介导的肿瘤抗原交叉呈递。综上所述,该研究构建的原位疫苗能够同时促进抗原的自呈递和交叉呈递,增强抗肿瘤免疫,有效克服肿瘤对免疫治疗的耐药性。
Ge Chen. et al. Ultrasound-Activatable In Situ Vaccine for Enhanced Antigen Self- and Cross-Presentation to Overcome Cancer Immunotherapy Resistance. ACS Nano. 2024
DOI: 10.1021/acsnano.4c04045
https://pubs.acs.org/doi/10.1021/acsnano.4c04045



















