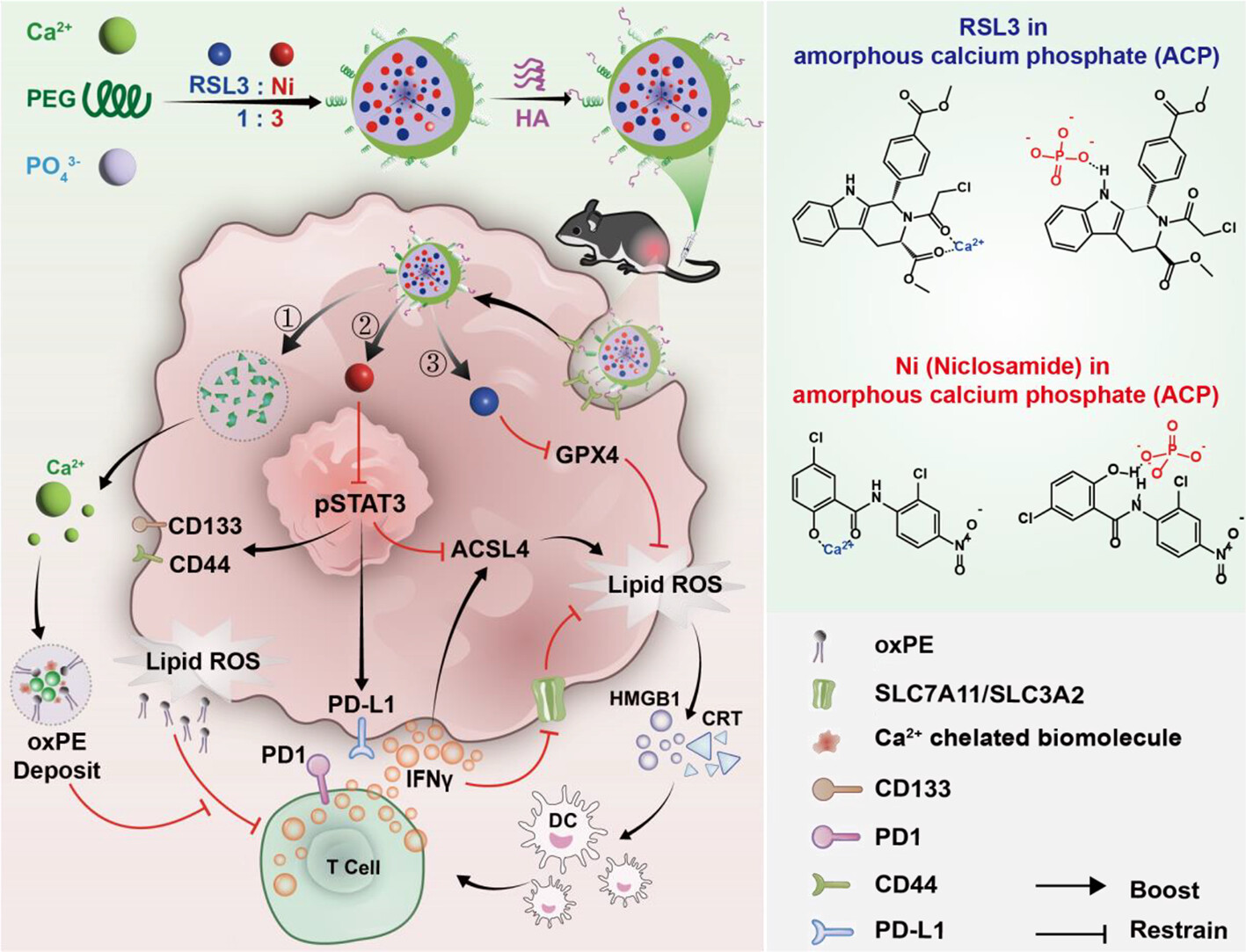
癌症干细胞 (CSC) 是改善抗癌治疗效果并消除复发的有希望的目标,但它们的治疗仍然是一项重大挑战。鉴于此,重庆大学罗忠等研究人员报告了一种纳米整合策略,通过时空控制的 STAT3 调节信号回路重编程来实现 CSC 靶向的铁死亡免疫疗法。
具体来说,STAT3 抑制剂氯硝柳胺 (Ni) 和实验性铁死亡药物 (1S, 3R)-RSL3 (RSL3) 通过生物矿化 (CaP-PEG-HA@Ni/RSL3) 整合到透明质酸修饰的无定形磷酸钙 (ACP) 纳米单元中,可被 CD44 过表达的 CSC 识别并以同步方式释放。
Ni 抑制 CSC 内在 STAT3-PD-L1 轴以刺激适应性免疫并增强 CD8+ T 细胞的干扰素γ (IFNγ) 分泌,从而下调 SLC7A11 和 SLC3A2,从而阻止谷胱甘肽生物合成。同时,Ni 依赖的 STAT3 抑制还通过下游信号传导和 IFNγ 反馈上调 ACSL4。这些效应与 RSL3 介导的 GPX4 失活协同作用,诱导明显的铁死亡。
此外,CaP-PEG-HA@Ni/RSL3 还会损害免疫抑制性 M2 样肿瘤相关巨噬细胞,而降解的 ACP 释放的 Ca2+ 离子可以与铁死亡 CSC 中的脂质过氧化物螯合,以避免 CD8+ T 细胞抑制,从而增强活化 CD8+ T 细胞的效应功能。此项研究为治疗难治性癌症提供了一种协同的铁死亡免疫治疗方法。
参考文献:
Youbo Zhao, Yang Fei, Yang Zhao, Menghuan Li, Yan Hu, Kaiyong Cai, Shu-Hong Yu, and Zhong Luo. Biomineralization-Tuned Nanounits Reprogram the Signal Transducer and Activator of Transcription 3 Signaling for Ferroptosis-Immunotherapy in Cancer Stem Cells. ACS Nano 2024 18 (32), 21268-21287
DOI: 10.1021/acsnano.4c05084
https://pubs.acs.org/doi/10.1021/acsnano.4c05084


















