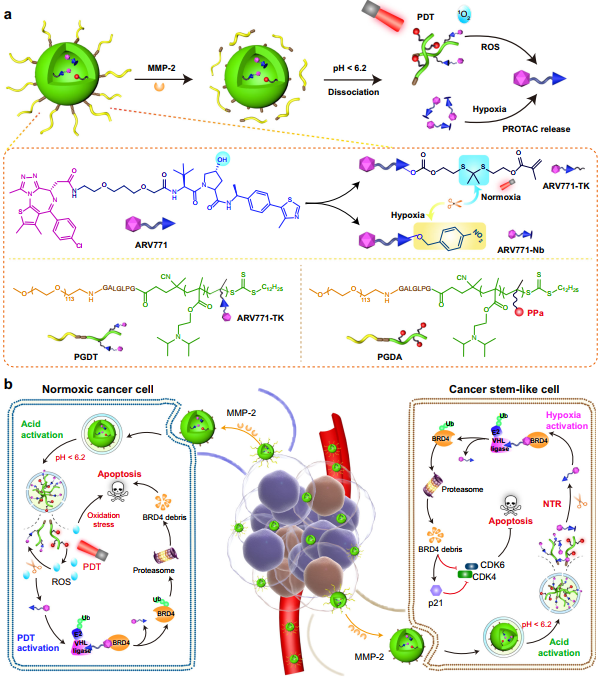
蛋白水解靶向嵌合体(PROteolysis-TArgeting Chimeras,PROTACs)的抗肿瘤性能会受到肿瘤特异性不足和药代动力学差等问题的限制。此外,肿瘤异质性(尤其是驱动肿瘤生长和复发的癌症干细胞类细胞)也会进一步放大PROTACs的缺点。有鉴于此,中国科学院上海药物研究所于海军研究员、复旦大学徐辉雄教授和华东师范大学徐志爱教授设计了一个限域的PROTAC纳米平台,该平台集成了活性氧(ROS)激活和响应乏氧的PROTAC前药,可精确调控溴结构域和超末端蛋白4的表达,实现肿瘤根除。
本文要点:
(1)这些PROTAC纳米颗粒可通过响应基质金属蛋白酶-2以选择性地聚集和深入到肿瘤内部。研究发现,光活性会在酸性的细胞内环境中被重新激活,并且在常氧微环境中进行的光动力疗法可通过产生ROS实现PROTAC的释放。
(2)此外,在过表达硝基还原酶的乏氧肿瘤干细胞样细胞中,乏氧反应性PROTAC前药也会发生恢复。实验结果表明,该研究构建的限域PROTAC纳米平台能够在常氧和乏氧环境中有效降解BRD4,以显著抑制乳腺和头颈部肿瘤模型的肿瘤进展。
Jing Gao. et al. A region-confined PROTAC nanoplatform for spatiotemporally tunable protein degradation and enhanced cancer therapy. Nature Communications. 2024
https://www.nature.com/articles/s41467-024-50735-w



















