
发展能够快速修饰特定赖氨酸基团的亲电配体目前仍然是一个非常大的挑战,人们发现水杨酸醛(Salicylaldehyde)抑制剂能够与蛋白质激酶(kinase)结合形成稳定的亚胺结合物。但是这种加合物中的赖氨酸通常包埋在疏水环境。人们目前还不清楚这种方法是否有可能应用于修饰蛋白质表面的赖氨酸,因为蛋白质表面的赖氨酸形成的亚胺可能快速的发生水解。
有鉴于此,加州大学Jack Taunton教授等报道设计一系列氨基甲基修饰的水杨酸醛,能够对ATP酶的Hsp90结构域完全溶剂化的赖氨酸进行靶向结合。
本文要点
(1)
通过系统性的调节水杨酸醛的分子方向,发现停留时间更久的配体,而且发现以不可逆方式结合Hsp 90的配体得到最好效果。
(2)
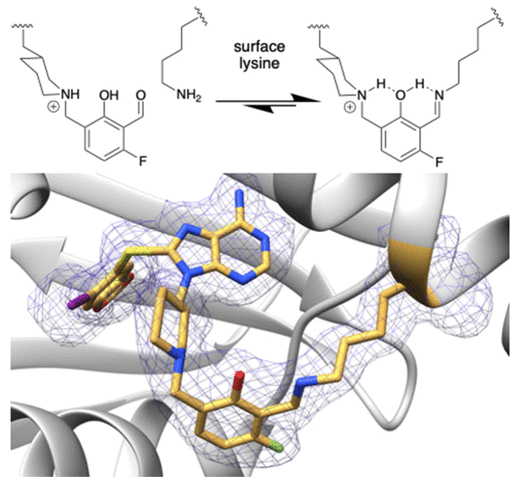
晶体结构分析的结果显示,分子内氢键呈现菊花链网络(daisy-chain network),其中水杨酸醛亚胺被相邻的哌啶配体锁定。这项研究展示氨基甲基水杨酸醛化合物能够形成构象稳定的抗水解亚胺结构,对于在蛋白质表面发生溶剂化的赖氨酸结合位点同样可行。
参考文献
Jacqueline Weaver, Gregory B. Craven, Linh Tram, Hao Chen, and Jack Taunton*, Aminomethyl Salicylaldehydes Lock onto a Surface Lysine by Forming an Extended Intramolecular Hydrogen Bond Network, J. Am. Chem. Soc. 2024
DOI: 10.1021/jacs.4c04314
https://pubs.acs.org/doi/10.1021/jacs.4c04314


















