
肠道共生生物(Flavonflector plautii)对红细胞A抗原末端的α-N-乙酰半乳糖胺的酶切包括两步,其中首先脱乙酰酶产生末端半乳糖胺残基,随后第二个α-半乳糖胺进行酶切割糖,留下O血型的H抗原。一个问题在于,这种酶如何能够避免质子化胺导致过渡态的静电失稳,这个问题促进了作者进行结构表征研究。
有鉴于此,不列颠哥伦比亚大学Khorana讲席教授Stephen G. Withers等报道结合机理研究,发现Co在α-半乳糖胺酶(α-Galactosaminidase)在催化切断抗原血型抗原(Blood Group Antigens)过程中起到辅酶作用。
本文要点
(1)
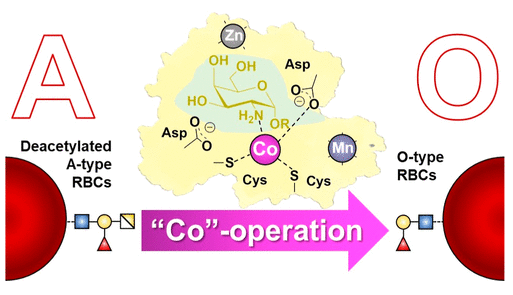
这种GH36酶的三维结构表明,虽然酶的整体结构和双置换机制与糖苷水解酶Clan-D的其他成员非常相似,但活性位点同时含有一个钴离子,这个Co离子与底物的2位点的胺配位。此外,另外两种金属(锌和锰)似乎起着结构上的作用,而已知没有其他Clan-D糖苷酶表现出任何金属依赖性。事实上,人们从来没有在其他糖苷酶发现需要如此多样的金属离子。
(2)
底物胺与钴的配位能够抑制其在酶的操作pH下的质子化,从而免于经受氧代卡宾离子型过渡态的静电失稳问题,从而能够促进反应的正常进行。这个方法为保持一个结构相似的活性位点提供一种解决方案。
Stephen G. Withers教授是加拿大不列颠哥伦比亚大学的Khorana讲席教授、英国皇家学会院士、加拿大皇家学会院士主要从事糖类代谢酶的作用机制、糖类合成酶分子改造、糖代谢酶小分子药物设计研究,在糖化学生物领域有着卓越成就和重大影响。1992年获加拿大皇家学会卢瑟福奖,2002年获国际碳水化合物组织惠斯勒奖,2012年获英国皇家学会百年奖。
参考文献
Yuqing Tian, Liam J. Worrall, Lyann Sim, Feng Liu, Seyed A. Nasseri, Peter Rahfeld, Wanmeng Mu, Jayachandran N. Kizhakkedathu, Natalie C. J. Strynadka, and Stephen G. Withers*, Cobalt as a Cofactor for α-Galactosaminidase-Catalyzed Cleavage of Blood Group Antigens,ACS Catal. 2024, 14, 13497–13508
DOI: 10.1021/acscatal.4c03643
https://pubs.acs.org/doi/10.1021/acscatal.4c03643


















