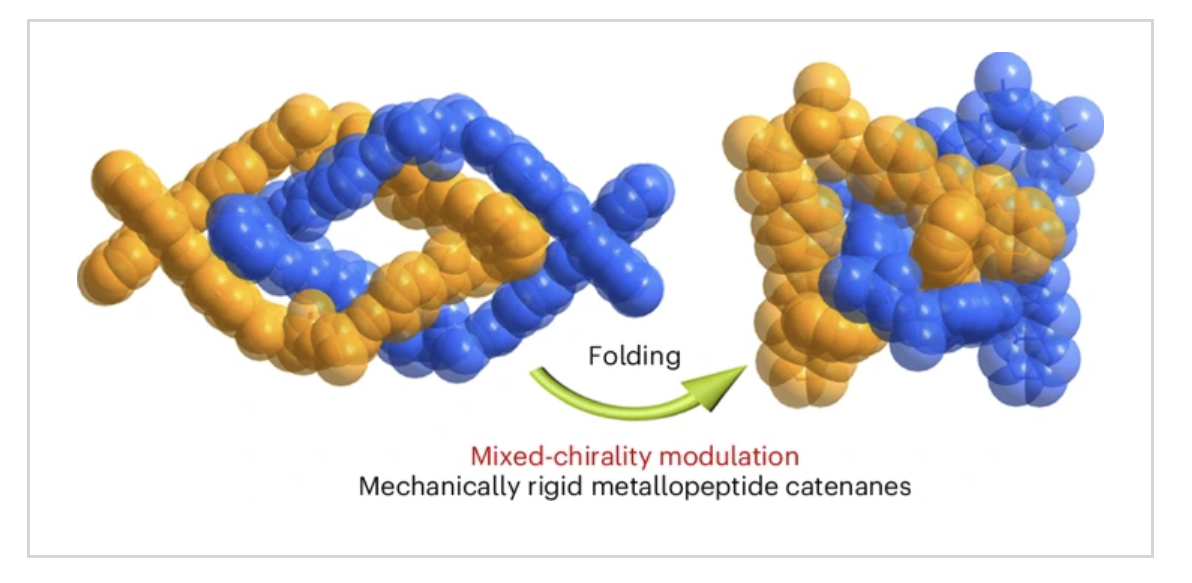
天然蛋白质必须折叠成复杂的三维结构,以实现对生物功能至关重要的优异机械性能,但这在合成系统中非常难以控制。因此,由错误折叠引起的低机械刚性和稳定性问题限制了自组装肽材料的物理和化学性质。近日,布里斯托大学Anthony P. Davis、上海交通大学崔勇、董金桥、施雷雷介绍了一种混合手性策略,可以提高拓扑互锁金属肽纳米结构的折叠效率。
天然蛋白质必须折叠成复杂的三维结构,以实现对生物功能至关重要的优异机械性能,但这在合成系统中非常难以控制。因此,由错误折叠引起的低机械刚性和稳定性问题限制了自组装肽材料的物理和化学性质。近日,布里斯托大学Anthony P. Davis、上海交通大学崔勇、董金桥、施雷雷介绍了一种混合手性策略,可以提高拓扑互锁金属肽纳米结构的折叠效率。
本文要点:
1) 异手性肽衍生连接体的有序纠缠可以折叠成紧凑的三维链状结构。这些折叠介导的二级结构变化不仅产生源自单个肽链的仿生结合,而且通过紧密连锁的方式导致强烈的手性扩增。
2) 这种战略性的“手性突变”将它们的排列改变为三维结构,对于实现金属肽晶体中异常机械刚性至关重要,金属肽晶体的杨氏模量为157.6 GPa,比自然界中最坚硬的蛋白质材料高出约十倍。
Xing Kang et.al Mechanically rigid metallopeptide nanostructures achieved by highly efficient folding Nature Synthesis 2024
DOI: 10.1038/s44160-024-00640-3
https://doi.org/10.1038/s44160-024-00640-3