细胞外基质的生物力学贡献支撑着细胞的生长和增殖、分化、信号转导和其他命运决定。因此,力学可以在时空上改变(特别是以可逆的方式)的生物材料对于研究这些机械生物学现象非常有价值。
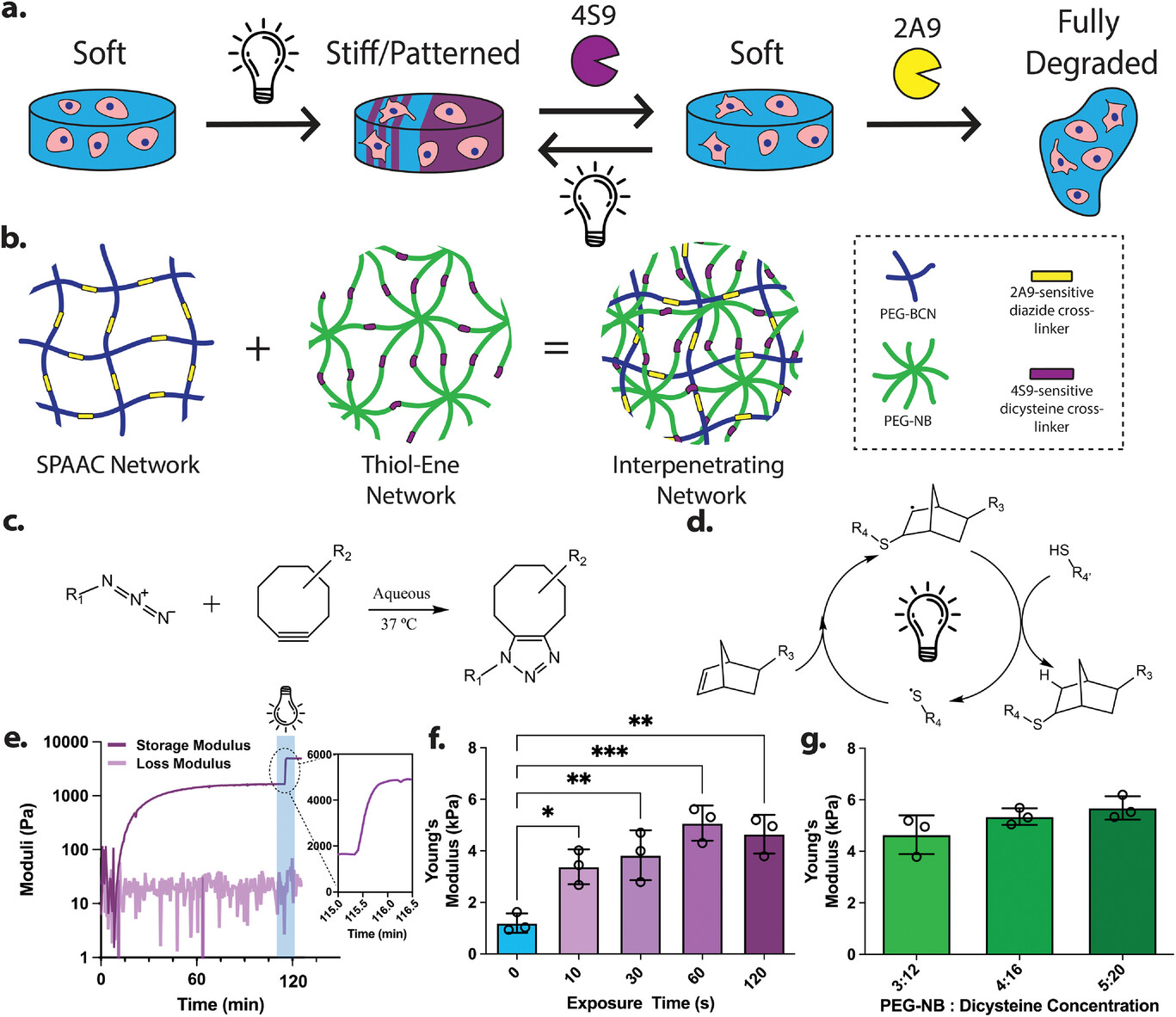
华盛顿大学Cole A. DeForest等人介绍了一种基于聚乙二醇 (PEG) 的水凝胶模型,该模型由两个相互渗透的逐步增长网络组成,它们通过基本正交的生物正交化学独立形成,并通过不同的重组分选酶依次降解,提供可逆可调的刚度范围,涵盖健康和患病的软组织(例如 500 Pa–6 kPa),同时以近乎“生物不可见”的方式进行终端细胞恢复,以进行汇集和/或单细胞分析。通过基于掩模和双光子光刻实现对主要支撑网络内凝胶化的时空控制;这些硬化的图案化区域随后可以在基于分选酶的二次网络降解后恢复到原始的柔软状态。
使用这种方法,研究了 4D 触发的网络机械变化对人类间充质干细胞形态和 Hippo 信号以及 Caco-2 结肠直肠癌细胞机械记忆的影响(使用转录组学和代谢测定)。该平台有望在研究和指导较软基质中的机械生物学现象、图案化细胞命运和疾病解决方面具有广泛的用途。
参考文献:
I. Kopyeva, E. C. Goldner, J. W. Hoye, S. Yang, M. C. Regier, J. C. Bradford, K. R. Vera, R. C. Bretherton, J. L. Robinson, C. A. DeForest, Stepwise Stiffening/Softening of and Cell Recovery from Reversibly Formulated Hydrogel Interpenetrating Networks. Adv. Mater. 2024, 2404880.
https://doi.org/10.1002/adma.202404880


















