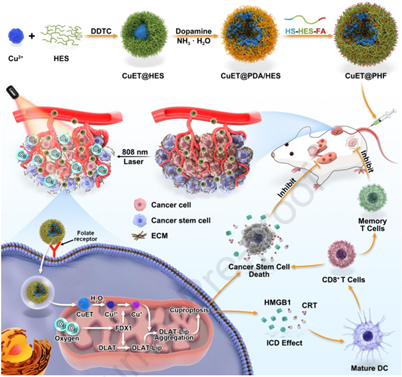
铜死亡是一种需要将铜离子递送到线粒体中以触发三羧酸(TCA)循环蛋白聚集的新型细胞死亡形式,已在多种癌细胞中被观察到。然而,铜死亡是否会发生在癌症干细胞(CSCs)中目前仍不明确。由于CSCs通常存在于三阴性乳腺癌(TNBC)的乏氧肿瘤微环境(TME)中,因此铜死亡蛋白FDX1的表达会被抑制,进而导致铜死亡的抗癌功效降低。有鉴于此,华中科技大学李子福教授和杨祥良教授利用聚多巴胺和羟乙基淀粉来稳定铜离子载体CuET纳米晶体,开发了一种对ROS响应的主动靶向铜死亡纳米药物(CuET@PHF),并将其用于根除CSCs。
本文要点:
(1)具有光热效应的CuET@PHF可通过肿瘤力学正常化克服肿瘤乏氧,从而导致4T1 CSCs发生增强的铜死亡和免疫原性细胞死亡。研究发现,CuET@PHF联合温和光热疗法不仅能显著抑制肿瘤生长,还能通过消除CSCs和增强抗肿瘤免疫反应以有效抑制肿瘤的复发和远端转移。
(2)综上所述,该研究首次证明了CSCs能够发生铜死亡,揭示了干扰乏氧可增强铜死亡癌症治疗,并建立了一种通过同时消除CSCs和增强抗肿瘤免疫来实现有效的癌症治疗的新范式。
Chen Xiao. et al. A cuproptosis-based nanomedicine suppresses triple negative breast cancers by regulating tumor microenvironment and eliminating cancer stem cells. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224002977



















