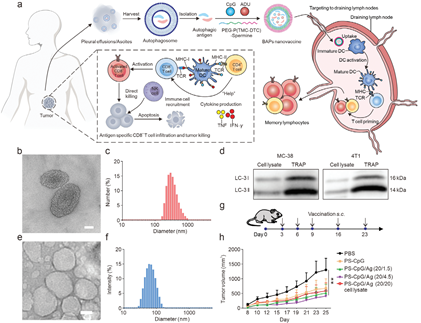
基于肿瘤细胞裂解物的个性化癌症疫苗为癌症免疫治疗带来了新的希望。然而,由于肿瘤抗原的免疫原性较弱,因此这类疫苗难以产生强有力的治疗效果。从癌症患者的胸腔积液和腹水中获得的自噬体是肿瘤新抗原的丰富储存库,其具有增强的免疫原性。然而,将自噬体作为个性化癌症疫苗的策略仍存在淋巴靶向性能不理想和抗原呈递细胞内吞等问题。有鉴于此,苏州大学钟志远教授和王慎强教授通过精准融合自噬体衍生的新抗原和两种能够靶向淋巴结的佐剂构建了一种增强的仿生自噬体纳米疫苗(BAPs),其可以有效地引发抗肿瘤免疫。
本文要点:
(1)氧化还原响应性BAPs可促进抗原呈递细胞内的胞质疫苗打开,从而暴露佐剂和抗原以刺激产生强烈的免疫反应。BAPs可引起广谱的T细胞应答,以有效根除71.4%的肿瘤。研究发现,BAPs疫苗能够触发持久的T细胞应答,产生强大的保护作用,使100%小鼠免受肿瘤再攻击,并显著降低肿瘤发病率(87.5%)。
(2)在低免疫原性乳腺癌模型中,BAPs能够与检查点阻断疗法相协同以抑制肿瘤生长。综上所述,该研究设计的仿生方法能够用于构建性能强大、具有高通用性的纳米疫苗制剂,从而实现个性化癌症免疫治疗。
Liping Qu. et al. A Biomimetic Autophagosomes-Based Nanovaccine Boosts Anticancer Immunity. Advanced Materials. 2024
DOI: 10.1002/adma.202409590
https://onlinelibrary.wiley.com/doi/10.1002/adma.202409590



















