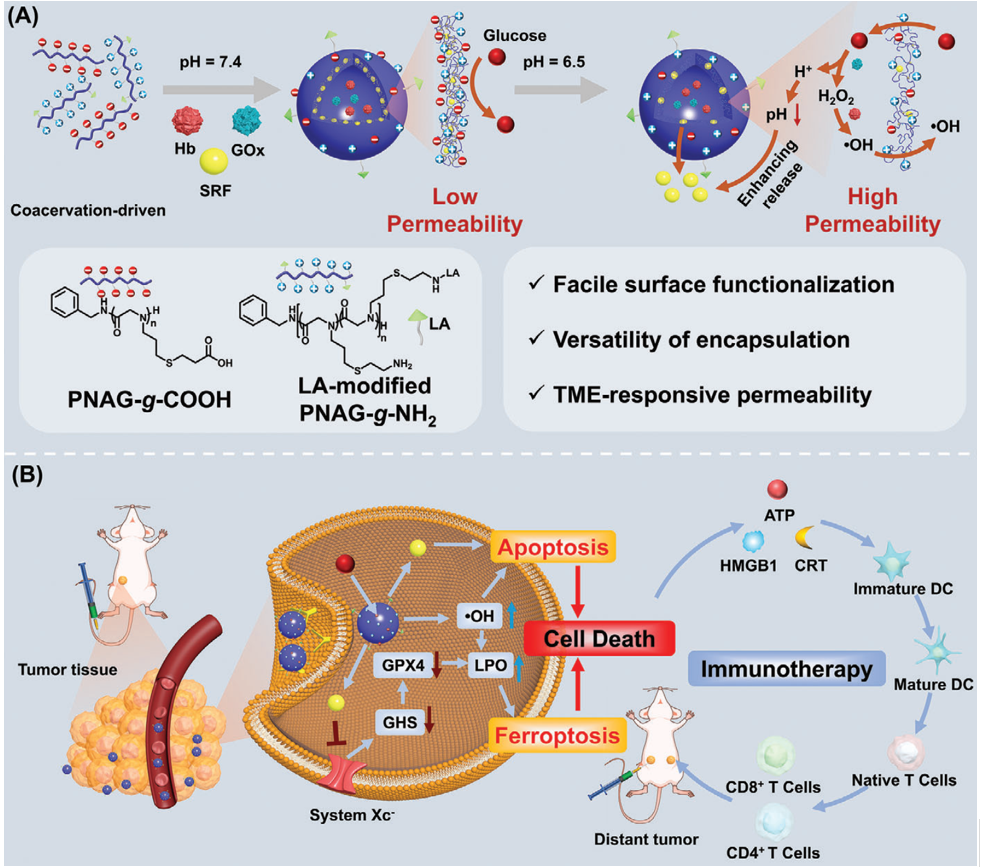
酶催化级联是一种极具发展前景的癌症靶向治疗方法,但其临床效果仍会因递送过程中的功能丧失而受到严重阻碍。复杂凝聚是设计功能性纳米反应器的一个重要策略。有鉴于此,中国科学院长春应用化学研究所陈学思院士和吉林大学孙静教授开发了一个基于仿生同聚类肽、乳酸修饰、对肿瘤微环境(TME)响应的多电解质复合物囊泡(HGS-PCVs),其能够作为一种简单、智能和高效的纳米反应器。
本文要点:
(1)HGS-PCVs的TME响应性渗透性使得葡萄糖能够选择性地进入其内部,进而在肿瘤内引发酶催化级联反应。这一复杂过程能够产生有毒的羟基自由基,并同时降低pH。研究发现,pH的变化可增强索拉非尼(SRF)的释放,从而有效地促进靶癌细胞的铁死亡和细胞凋亡。
(2)HGS-PCVs不仅能够启动免疫原性细胞死亡,而且在诱导淋巴结内的树突状细胞成熟等方面也具有至关重要的作用。实验结果表明,HGS-PCVs可刺激适应性T细胞反应,从而有助于抑制体内远端肿瘤的生长。综上所述,该研究构建的PCVs在癌症免疫治疗领域中具有巨大的应用潜力。
Min Lin. et al. Coacervation-Driven Semipermeable Nanoreactors for Enzymatic Cascade-Mediated Cancer Combination Therapy with Enhanced Efficacy. Advanced Materials. 2024
DOI: 10.1002/adma.202407378
https://onlinelibrary.wiley.com/doi/10.1002/adma.202407378



















