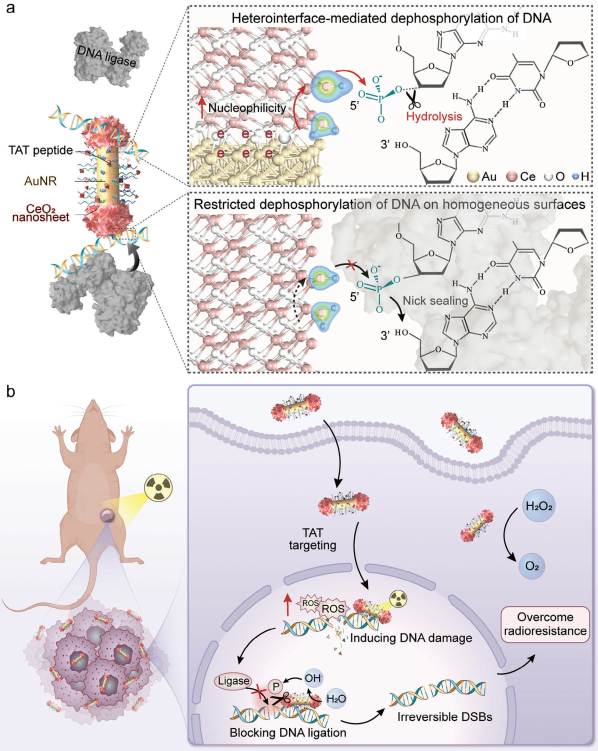
在分步放疗期间,肿瘤细胞中的DNA损伤修复会发生增强,最终导致癌症放射耐药和放疗失败。尽管已有研究开发了靶向特定DNA损伤修复通路的纳米放射增敏剂,但其仍难以解决基于多种通路机制的DNA修复。有鉴于此,上海交通大学凌代舜教授和李方园研究员设计了一种亲核工程化DNA连接阻断纳米放射增敏剂(DLBN),其含有经反式作用转录肽激活剂修饰的Au/CeO2异质纳米结构,可通过异质界面介导的DNA去磷酸化靶向抑制癌细胞核内的DNA连接,以有效克服癌症放射耐药。
本文要点:
(1)首先,靶向癌细胞核、具有肖特基型异质纳米结构的DLBN可通过模拟过氧化氢酶的活性和辐射引发的催化反应有效地增强辐射诱导的DNA损伤。研究发现,DLBN可利用Au/CeO2异质界面自发地将H2O解离为氢氧化物(一种亲核性更高的亲核试剂),从而通过促进亲核攻击以在DNA切刻处表现出显著的去磷酸化能力,有效阻断DNA连接(DNA损伤修复途径中的关键步骤),中断DNA的修复过程。
(2)实验结果表明,DLBN可通过克服治疗诱导的放射耐药实现放射耐药性细胞的重新增敏,进而导致未修复的DNA损伤的大量积累。综上所述,该研究能够为实现细胞核内DNA的去磷酸化提供新的见解,证明了基于异质纳米结构的放射增敏剂在阻断DNA连接以对抗治疗诱导的放射耐药性方面具有重要潜力。
Hongli Yang. et al. A Nucleophilicity-Engineered DNA Ligation Blockade Nanoradiosensitizer Induces Irreversible DNA Damage to Overcome Cancer Radioresistance. Advanced Materials. 2024
DOI: 10.1002/adma.202410031
https://onlinelibrary.wiley.com/doi/10.1002/adma.202410031



















