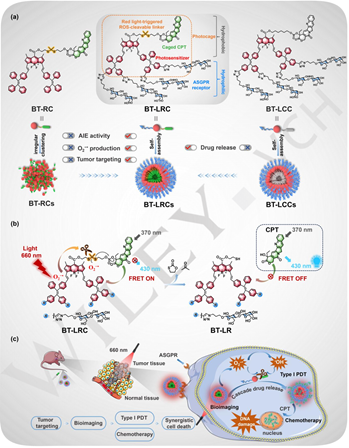
光笼是一种能够精确控制生物活性的空间和时间行为的新兴技术。然而,由红光/近红外光触发的光笼光解过程目前主要依赖于单线态氧(1O2),并且与其他活性氧(ROS)激活技术缺乏兼容性,因此难以实现高效、精准的治疗。有鉴于此,北京师范大学邢国文教授利用超氧阴离子自由基(O2−•)断裂的硫酮键将喜树碱(CPT)共价结合到杂化的BODIPY-TPE荧光基团中,开发了一种乳糖化光笼BT-LRC,以实现I型光动力治疗(PDT)和抗癌药物释放。
本文要点:
(1)由于纳米聚集体中相邻乳糖单位之间的碳水化合物相互作用(CCIs)的调节,该两亲性BT-LRC可以自组装形成具有聚集诱导发光(AIE)活性的纳米粒子(BT-LRCs)。研究发现,BT-LRCs能够通过乳糖相互作用调节的聚集产生丰富的O2−•,并有效释放DNA损伤剂CPT。
(2)实验结果表明,I型PDT和CPT化疗可在HepG2细胞和荷瘤小鼠模型中产生协同增强的治疗效果。此外,BT-LRCs固有的AIE特性也使得该光笼化前药具有优越的生物成像能力,从而能够为实现对PDT的实时示踪和精细调控以及光激活药物释放提供一个有效的工具。
Wei Zhou. et al. Glycosylated AIE-active Red Light-triggered Photocage with Precisely Tumor Targeting Capability for Synergistic Type I Photodynamic Therapy and CPT Chemotherapy. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202413350
https://onlinelibrary.wiley.com/doi/10.1002/anie.202413350



















