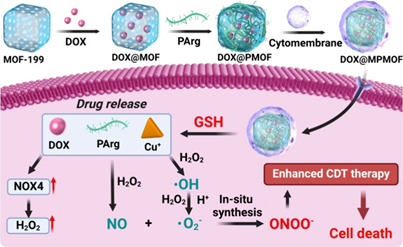
化学动力疗法(CDT)可通过芬顿或类芬顿反应产生羟基自由基(·OH)以诱导癌细胞死亡。与传统疗法相比,CDT可以有效克服耐药性问题,且副作用较低。然而,CDT的临床应用仍面临着·OH生成不足以及·OH在体内的寿命短等挑战。有鉴于此,新加坡国立大学刘斌教授和浙江大学平渊教授开发了一种基于过氧亚硝酸盐(ONOO−)的CDT纳米药物(DOX@PMOF),该药物由MOF-199、NO供体(PArg)和烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)激活剂(阿霉素,DOX)所组成。
本文要点:
(1)在DOX@PMOF中,MOF-199既是负载DOX的载体,也是触发CDT的Cu+源。被癌细胞摄取后,高浓度谷胱甘肽(GSH)可将MOF-199还原为Cu+,然后与H2O2反应生成·OH。此外,释放的DOX也能够上调NOX4的表达,导致H2O2水平升高,从而促进高效的类芬顿反应以产生足够的·OH。研究发现,PArg可响应肿瘤微环境产生大量NO,实现NO和·OH级联,原位合成ONOO−。
(2)与·OH相比,ONOO−毒性更大,寿命和扩散距离也更长,因此能够实现更有效的CDT。为了进一步提高体内治疗效果,研究者在DOX@PMOF上包被了一层同源细胞膜,从而构建了一种肿瘤靶向纳米药物(DOX@MPMOF)。实验结果表明,该药物能够有效抑制肿瘤的生长和转移,并且具有良好的生物安全性。
Bowen Li. et al. Tumor Microenvironment-Activated In Situ Synthesis of Peroxynitrite for Enhanced Chemodynamic Therapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c10012
https://pubs.acs.org/doi/10.1021/acsnano.4c10012



















