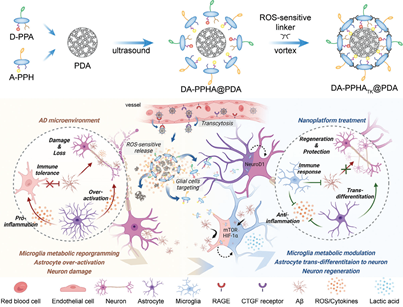
生理屏障的强大保护作用和不明确的致病机制等问题严重阻碍了阿尔茨海默病(AD)药物的开发。作为中枢神经系统的保护者,神经胶质细胞的免疫-代谢功能和干性会在退行过程中保持休眠状态,从而导致同时实现靶向和调节成为了一项严峻的挑战。有鉴于此,复旦大学蒋晨教授开发了一种由肽-药物偶联物和炎症响应内核组成的模块化纳米平台。
本文要点:
(1)静脉给药后,该纳米平台可通过转胞吞作用穿过血脑屏障,并在氧化应激微环境中发生分解。研究发现,该纳米平台所释放的药物偶联物模块可以将羟氯喹(HCQ)和全反式维甲酸(ATRA)分别靶向递送给小胶质细胞和星形胶质细胞。慢性耐受性小胶质细胞的免疫功能可被代谢调节激活,而反应性星形胶质细胞则会转分化为功能性神经元。
(2)在转基因小鼠模型中,该纳米平台可有效降低有毒蛋白和炎症的水平,并同时增加神经元密度,以显著改善学习和记忆衰退。综上所述,该研究开发的模块化纳米平台能够为实现炎症相关疾病的多细胞靶向联合纳米治疗提供重要的设计原则。
Peixin Liu. et al. A Peptide-Drug Conjugate-Based Nanoplatform for Immunometabolic Activation and In Situ Nerve Regeneration in Advanced-Stage Alzheimer’s Disease. Advanced Materials. 2024
DOI: 10.1002/adma.202408729
https://onlinelibrary.wiley.com/doi/10.1002/adma.202408729



















