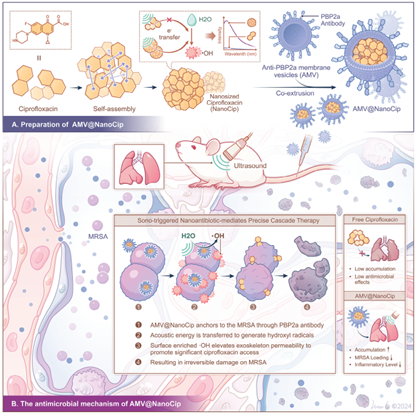
细菌引起的下呼吸道感染是一个日益严重的全球性健康问题。传统抗生素以及靶向下呼吸道的给药方法的无效性会导致治疗效果不佳。有鉴于此,厦门大学刘刚教授和浙江中医药大学蒋莱教授构建了呈递PBP2a抗体的膜纳米囊泡(AMVs),其能够靶向耐甲氧西林金黄色葡萄球菌(MRSA)表面的青霉素结合蛋白变体,并通过氢键驱动的自组装首次开发了具有自产生声动力特性、可同时保持其固有的药理学功效的纯环丙沙星纳米颗粒(NanoCip)。
本文要点:
(1)研究者将NanoCip颗粒与AMVs进行集成,制备了一种新型仿生纳米药物AMV@NanoCip。该制剂可在体内外模型中表现出显著的MRSA靶向亲和力和增强的抗菌活性。经超声刺激后,AMV@NanoCip对MRSA的体外灭菌率可达到99.99%以上,细菌减少量超过5.14 Log CFU。
(2)实验进一步通过原核生物转录组学分析阐明了AMV@NanoCip与超声相结合破坏MRSA外骨骼的协同机制。在MRSA诱导的肺炎动物模型中,AMV@NanoCip+US能够大幅降低肺部的细菌负荷(99.99%,4.02 Log CFU)。综上所述,该研究开发的序贯治疗策略(粘附-膜破坏-协同治疗)能够为对抗细菌感染提供一个创新的治疗方法。
Linyu Ding. et al. Sono-Triggered Biomimetically Nanoantibiotics Mediate Precise Sequential Therapy of MRSA-Induced Lung Infection. Advanced Materials. 2024
DOI: 10.1002/adma.202403612
https://onlinelibrary.wiley.com/doi/10.1002/adma.202403612



















