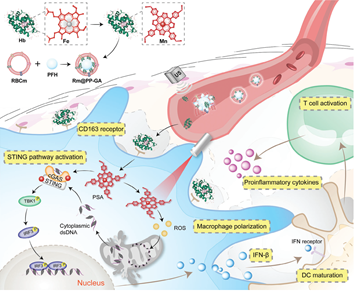
免疫疗法是一种非常有效的癌症治疗策略。能够激活环鸟苷单磷酸腺苷单磷酸合成酶(cGAS)-干扰素基因(STING)通路的刺激剂(如Mn2+)可促进肿瘤相关巨噬细胞(TAM)向M1表型极化。然而,Mn2+在体内的高降解率和毒性等问题仍会严重阻碍其在临床免疫治疗中的应用。有鉴于此,南京大学吴锦慧教授、Song Liu和南京师范大学苏志教授合成并筛选了用于Mn2+转运的锰卟啉,即光-STING激动剂(PSAs),并将其包封为具有肿瘤组织和TAM双重特异性的核-壳纳米颗粒Rm@PP-GA。
本文要点:
(1)与Mn2+相比,PSAs不仅具有更高的Mn2+递送效率,而且能够在光照下产生活性氧,促进线粒体DNA释放,以激活cGAS-STING途径。在Rm@PP-GA中,珠蛋白和红细胞膜(Rm)能够实现模拟红细胞胞葬作用的递送。Rm可有效延长体内循环周期,而珠蛋白则可使PSAs通过CD163受体被TAMs摄取。
(2)在超声作用下,纳米颗粒中的全氟己烷能够介导Rm发生破裂,以实现药物的特异性释放,导致TAM复极化、树突状细胞成熟以及T淋巴细胞浸润,从而实现有效的肿瘤根除。综上所述,该研究通过模拟红细胞胞葬作用的模式递送新型PSAs的策略能够优化癌症免疫治疗。
Zhiyan Li. et al. Novel Photo-STING Agonists Delivered by Erythrocyte Efferocytosis-Mimicking Pattern to Repolarize Tumor-Associated Macrophages for Boosting Anticancer Immunotherapy. Advanced Materials. 2024
DOI: 10.1002/adma.202410937
https://onlinelibrary.wiley.com/doi/10.1002/adma.202410937



















