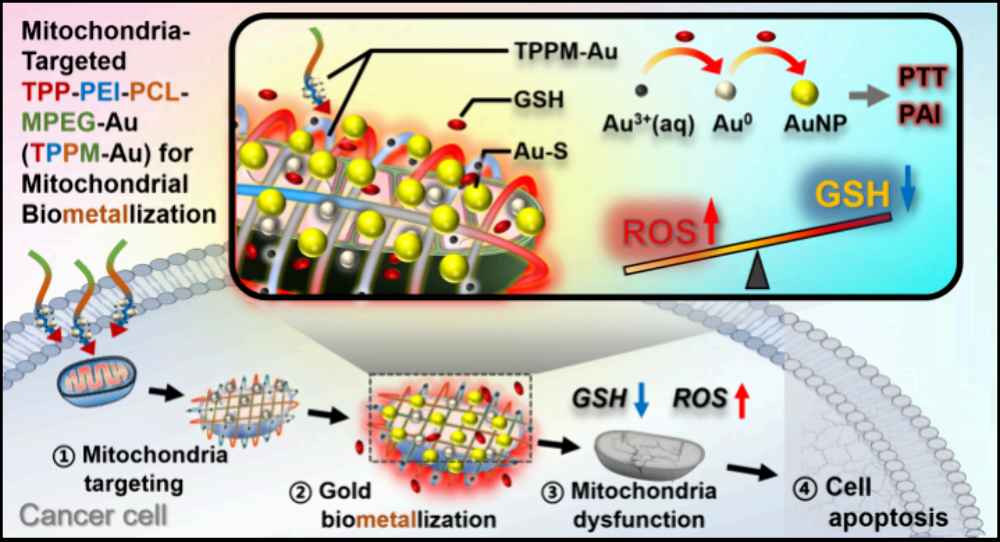
具有细胞干预功能的亚细胞生物矿化系统在癌症治疗领域中具有巨大的应用潜力。然而,缺乏亚细胞特异性、离子浓度高、生物矿化所需的孵育时间长等问题仍会严重限制该策略的体内治疗效果。有鉴于此,厦门大学霍帅东教授、吴云龙教授和新加坡科技研究局(A*STAR)李子彪研究员开发了一种靶向线粒体的聚合物-金复合物(TPPM-Au),其能够通过实现线粒体的生物金属化(机制与生物矿化过程类似)用于体内癌症治疗。
本文要点:
(1)与正常细胞相比,含TPP的TPPM-Au能将更多的Au3+选择性地递送到癌细胞的线粒体中。Au3+会迅速矿化形成金纳米粒子(GNPs),并消耗大量的抗氧化剂谷胱甘肽(GSH)。研究发现,产生的GNPs可通过与GSH形成Au−S的方式进一步地消耗GSH,导致活性氧(ROS)的积累,从而损害线粒体功能,诱导细胞凋亡。
(2)实验结果表明,TPPM-Au具有优越的肿瘤穿透性、优异的光热效率和光声特性,可通过时空监测的线粒体靶向生物金属化和光热疗法等过程抑制肿瘤的生长。综上所述,该研究构建的线粒体靶向金生物金属化治疗平台能够为推动亚细胞靶向生物金属化或生物矿化系统在癌症治疗中的应用提供新的见解。
Zheng Luo. et al. Mitochondria-Targeted Gold Biometallization for Photoacoustically Visualized Photothermal Cancer Therapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c08567
https://pubs.acs.org/doi/10.1021/acsnano.4c08567



















