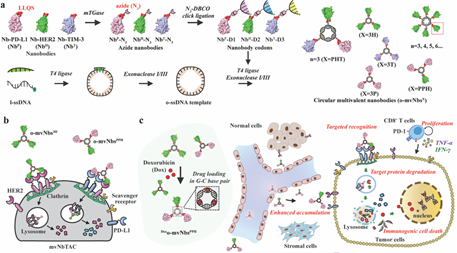
多特异性疗法在药物递送、蛋白质降解和细胞募集等方面具有重要的应用潜力,其可以解决肿瘤异质性、耐药性和免疫逃避等临床问题。然而,如何对其进行模块化工程仍是一项极具挑战性的难题。有鉴于此,中国科学院杭州医学研究所张鹏晖研究员、李娟研究员、Jingyi Chen和西安交通大学温玉荣教授利用DNA打印技术在环形模板上编码不同的纳米抗体密码子,从而构建了一种靶向降解平台,即多价纳米抗体靶向嵌合体(mNbTACs)。
本文要点:
(1)同种或异种mNbTACs能够以多价方式特异性地识别膜靶标,并同时募集清道夫受体,从而可以高效、选择性地促进多种蛋白质的网格蛋白/小窝依赖性内吞和溶酶体降解。研究发现,具有双特异性、负载多柔比星的mNbTAC(DoxO-mvNbsPPH)能够在肿瘤部位被动积累,可以特异性地与PD-L1和HER2靶点发生相互作用,并迅速转运到溶酶体中,以诱导有效的免疫原性细胞死亡,缓解免疫检查点逃避。
(2)实验结果表明,该过程能够协同增强先天免疫和适应性免疫,促进CD8+ T细胞在肿瘤微环境中的浸润和增殖(增加11倍),进而增强抗肿瘤疗效。综上所述,该研究开发的mNbTAC平台是一种能够通过多受体介导的内吞作用和溶酶体降解诱导目标蛋白质发生降解的多特异性治疗方法,无需溶酶体靶向受体,为利用细胞外蛋白质组进行疾病治疗提供了一个通用的模块化工具。
Shiqi Jiang. et al. Programmable Circular Multivalent Nanobody-Targeting Chimeras (mNbTACs) for Multireceptor-Mediated Protein Degradation and Targeted Drug Delivery. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202407986
https://onlinelibrary.wiley.com/doi/10.1002/anie.202407986



















