
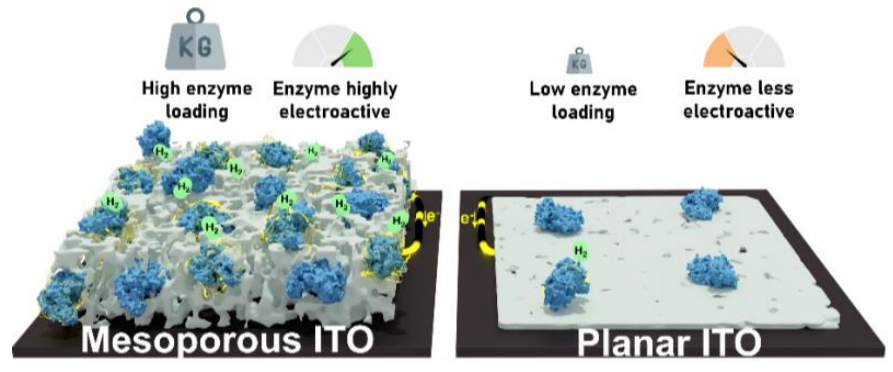
金属酶[FeFe]-氢化酶对未来制备绿氢的生物技术具有重要意义。有鉴于此,瑞士日内瓦大学Ross D Milton等报道开发了一种简单的两步功能化程序,将巴氏梭菌(“CpI”,Clostridium pasteurianum)的[FeFe]-氢化酶固定在介孔ITO电极,因此能够稳定的快速产生H2,电流密度达到8 mA cm-2。
作者使用原子力显微镜(AFM)、扫描电子显微镜(SEM)和电化学石英晶体微天平(EQCM)研究介孔ITO稳定和活化CpI进行电酶催化合成H2。
(2)
对介孔ITO的表面形貌和拓扑结构表征结果发现一种多级结构,包括空腔结构和结构明确的纳米粒子团聚体。通过比较CpI在介孔“纳米ITO”和平面ITO上的稳定性和电酶活性,并且研究介孔的影响,确定了纳米ITO表面的的CpI具有更高转化数目和更高的稳定性(随着时间变化的酶催化活性)。
参考文献
Sophie Webb, Astrit Veliju, Plinio Maroni, Ulf-Peter Apfel, Thomas Happe, Ross D Milton, Mesoporous Electrodes Enhance the Electrocatalytic Performance of [FeFe]-Hydrogenase, Angew. Chem. Int. Ed. 2024
DOI: 10.1002/anie.202416658
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202416658


















