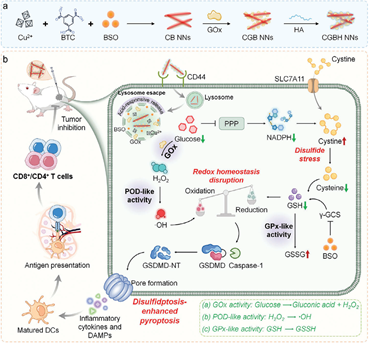
肿瘤细胞中的异常稳态具有维持细胞生长的关键作用。因此,破坏细胞内稳态有望成为一种有效、针对多种联合机制的抗肿瘤策略。有鉴于此,武汉大学张先正教授和刘传军教授设计并构建了一种具有多种类酶活性的铜基纳米诱导剂(CGBH NNs),其可通过破坏多种细胞内稳态诱导双硫死亡增强的焦亡,以实现有效的肿瘤免疫治疗。
本文要点:
(1)在肿瘤微环境(TME)中,CGBH NNs可破坏细胞内的葡萄糖稳态,抑制NADPH的产生,导致胱氨酸积累,进而阻断合成谷胱甘肽的底物和关键酶。研究发现,CGBH NNs能够通过基于多种酶活性(类谷胱甘肽过氧化物酶活性、类葡萄糖氧化酶活性和类过氧化物酶活性)的级联催化反应产生大量活性氧(ROS),以进一步破坏细胞内的氧化还原稳态,实现双硫死亡增强的焦亡。
(2)发生免疫原性焦亡的肿瘤细胞可以释放多种胞质内容物和炎症因子,进而能够通过促进免疫细胞浸润和重编程免疫抑制性TME等机制产生强大的免疫应答。实验结果表明,与免疫检查点阻断治疗联合后,CGBH NNs可有效抑制肿瘤生长,延长荷瘤小鼠的生存时间。综上所述,该研究开发了一种通过破坏细胞内稳态触发双硫死亡增强的焦亡以实现抗肿瘤免疫治疗的新策略。
Xiao-Kang Jin. et al. Disrupting Intracellular Homeostasis by Copper-Based Nanoinducer with Multiple Enzyme-Mimicking Activities to Induce Disulfidptosis-Enhanced Pyroptosis for Tumor Immunotherapy. Advanced Materials. 2024
DOI: 10.1002/adma.202410957
https://onlinelibrary.wiley.com/doi/10.1002/adma.202410957



















