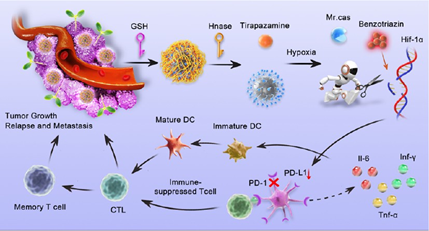
乏氧是多种实体肿瘤最典型的特征之一,其会导致免疫抑制性肿瘤微环境(immunosuppressive tumor microenvironment,TME),进而影响肿瘤治疗的效果。缓解乏氧是重塑乏氧TME以提高肿瘤免疫治疗的关键策略。然而,如何通过乏氧激活的基因编辑和前药来实现可控的肿瘤精准治疗仍是一项严峻的挑战。有鉴于此,南京中医药大学韩欣教授、Zhaorui Sun和南京邮电大学陆峰教授将二氧化硅包被的近红外二区(NIR-II)发射硫化银量子点作为负载CRISPR/Cas9系统的载体,以靶向乏氧诱导因子-1(HIF-1α)和实现肿瘤靶向成像。
本文要点:
(1)为了减少在非肿瘤细胞中的脱靶效应,以更好地控制安全风险,研究者设计了TME触发、级联激活的纳米诊疗平台(AA@Cas-H@HTS),其能够实现替拉帕胺(TPZ)前药的乏氧激活和CRISPR/Cas9核糖核蛋白的时空可控释放。研究发现,基因编辑和TPZ激活能够协同耗竭HIF-1α,以显著缓解肿瘤乏氧。
(2)实验结果表明,靶向HIF-1α可破坏程序性细胞死亡1/程序性细胞死亡配体1(PD-1/PD-L1)信号通路,有效重塑免疫抑制性TME,激活T细胞介导的抗肿瘤免疫。综上所述,该研究构建的TME触发、级联激活的纳米平台能够通过缓解乏氧实现增强的癌症免疫治疗。
Yu Ji. et al. Triggered Cascade-Activation Nanoplatform to Alleviate Hypoxia for Effective Tumor Immunotherapy Guided by NIR-II Imaging. ACS Nano. 2024
DOI: 10.1021/acsnano.4c11334
https://pubs.acs.org/doi/10.1021/acsnano.4c11334



















