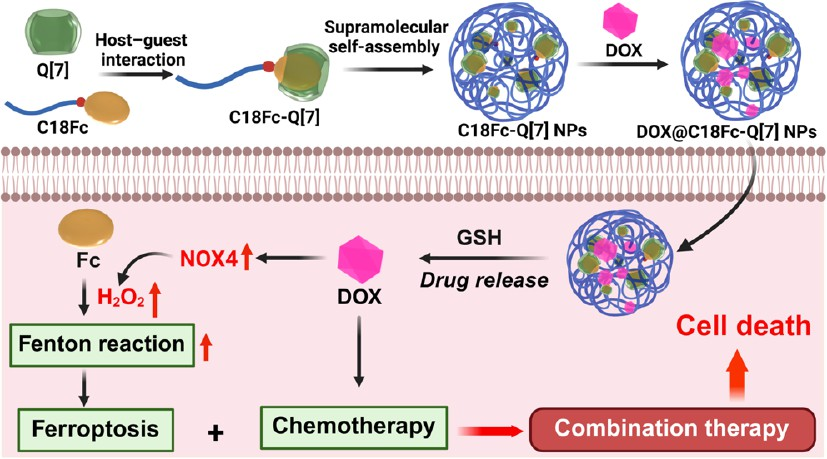
铁死亡能够利用生物体内Fe2+触发的芬顿反应导致脂质过氧化物(LPOs)过度积累,并诱导细胞死亡。已有研究表明,铁死亡可以有效规避传统凋亡疗法的耐药性问题。然而,由于胞内芬顿反应的效率较差,因此铁死亡治疗的临床应用仍面临严峻挑战。有鉴于此,新加坡国立大学/贵州大学Bowen Li、贵州大学Chongzhi Wu和李青教授开发了一种超分子自组装共递送纳米前药(DOX@C18Fc-Q[7] NPs),其由二茂铁(Fc)基超分子两亲体(C18Fc-Q[7])和烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)激活剂(多柔比星,DOX)组成。
本文要点:
(1)实验通过二硫键将Fc连接到疏水长链烷烃上,其能够与亲水性Q[7]发生相互作用以形成自组装两亲体C18Fc-Q[7]。研究发现,Q[7]和Fc之间的主客体相互作用可以有效增强Fc的溶解度,并同时保持Fe2+源的稳定性。此外,由于C18Fc-Q[7]具有良好的自组装性能,因此其也可以作为负载DOX的载体。
(2)在癌细胞中,谷胱甘肽(GSH)可触发纳米前药的分解,进而释放DOX以上调NOX4的表达和增加H2O2水平,从而能够促进芬顿反应,实现Fc诱导的铁死亡。与此同时,DOX可通过凋亡诱导细胞死亡,并进一步协同增强铁死亡治疗。体内研究结果表明,强化的铁死亡疗法可以有效抑制肿瘤的生长和转移,并同时保持良好的生物安全性。
Zhengwei Yu. et al. A Supramolecular Self-Assembled Nanoprodrug for Enhanced Ferroptosis Therapy. ACS Nano. 2024
DOI: 10.1021/acsnano.4c09254
https://pubs.acs.org/doi/10.1021/acsnano.4c09254



















