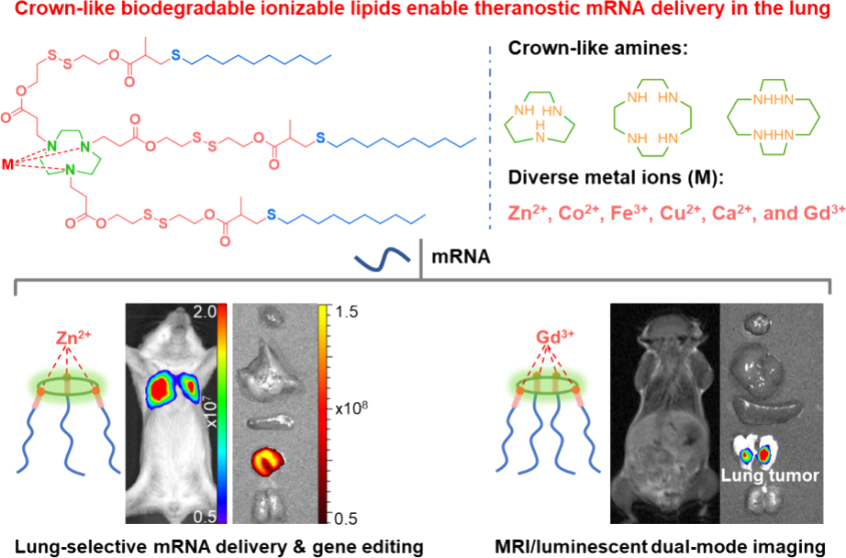
如何实现对特定类型细胞的系统性mRNA递送是一项严峻的挑战。有鉴于此,南开大学熊虎教授开发了一类冠状可生物降解的新型电离脂质(CBILs),其能够利用金属配位化学实现可预测的肺选择性mRNA递送。
本文要点:
(1)CBIL含有的冠状氨基内核能够与多种金属离子(如Zn2+)进行配位,以进一步调节脂质纳米颗粒(LNPs)的体内器官靶向行为。研究发现,由Zn-9C-SCC-10配制的LNPs可在系统性给药后将mRNA选择性地递送到肺部。静脉注射Cre mRNA(0.2 mg kg−1)后,Zn-9C-SCC-10 LNPs能够对肺上皮细胞和内皮细胞进行高效的基因编辑(效率分别为43%和61%),其性能也优于目前最先进的LNPs。
(2)与添加阳离子脂质(DOTAP)的DLin-MC3-DMA LNPs相比,该策略能够使肺部的mRNA表达增强44.6倍,并且具有显著提高的体内生物安全性。实验结果表明,含有顺磁性钆离子的Gd-12C-SCC-10 LNPs可将mRNA有效递送至癌细胞,并且能够通过磁-生物发光双模态成像成功实现肺肿瘤可视化,以促进对肺癌的早期诊断。综上所述,该研究为合理设计可预测的LNPs开辟了一条新的途径,有望能够为将mRNA递送到肺组织中的特定细胞以治疗多种疾病提供一个新的策略。
Zhaoming Chen. et al. Crown-like Biodegradable Lipids Enable Lung Selective mRNA Delivery and Dual-Modal Tumor Imaging In Vivo. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c14500
https://pubs.acs.org/doi/10.1021/jacs.4c14500



















