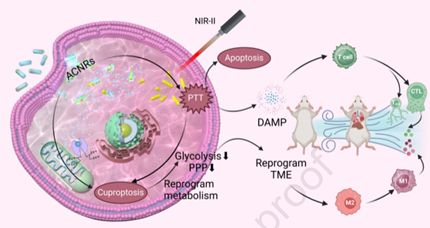
肿瘤代谢异常会导致肿瘤生长、转移和复发。重编程肿瘤代谢和激活有效的抗肿瘤免疫应答能够实现有效的肿瘤消除。参与铜死亡的铜基纳米材料在这两方面都表现出了广阔的应用前景,但其效率仍受到Cu稳态和螯合剂毒性等问题的限制。有鉴于此,陆军军医大学张冬教授和周春宇研究员成功制备了对pH响应的AuNRs@Cu2O核壳等离激元杂化纳米棒(ACNRs),其在肿瘤部位能够实现微环境控释和铜死亡-光热联合治疗。
本文要点:
(1)ACNRs内核具有优异的NIR-II光热特性,可提高细胞内的铜浓度,以引发严重的铜死亡,并诱导肿瘤细胞免疫原性死亡。体内研究表明,ACNR对原发性、转移性和复发性肿瘤均具有良好的治疗作用。ACNRs诱导的铜死亡和PTT能够重编程能量代谢,导致乳酸的产生减少。研究发现,代谢重编程有助于重塑免疫抑制性肿瘤微环境,促进免疫细胞的浸润,增强PTT触发的免疫应答。
(2)研究者通过代谢组学分析探究了ACNRs的治疗机制。实验结果表明,ACNRs + PTT治疗可抑制肿瘤细胞的戊糖磷酸途径和糖酵解途径。糖酵解抑制会导致ATP的合成减少,以阻碍能量依赖性铜外排,从而能够进一步促进铜死亡。综上所述,该研究设计了一种基于铜死亡的癌症治疗新策略,能够为实现纳米药物介导的代谢调节提供新的见解。
Qian Xie. et al. Responsive Plasmonic Hybrid Nanorods Enables Metabolism Reprogramming via Cuproptosis-Photothermal Combined Cancer Therapy. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224005064



















