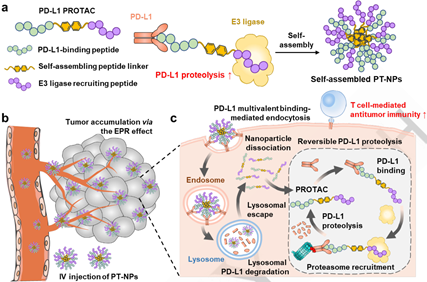
靶向蛋白水解嵌合体(Proteolysis-targeting chimeras,PROTACs)是一种通过泛素-蛋白酶体系统对癌症相关蛋白进行特异性、持久性降解的有效技术。然而,疏水性、细胞渗透性差和肿瘤靶向能力不足等问题仍会严重影响PROTACs的治疗效果。有鉴于此,梨花女子大学Kwangmeyung Kim和韩国科学技术研究院Man Kyu Shim开发了自组装肽衍生的PROTAC纳米颗粒(PT-NPs),并将其用于精准、持久地降解肿瘤中的程序性死亡配体1(PD-L1)。
本文要点:
(1)实验通过将两亲性肽衍生的PROTAC(CLQKTPKQC-FF-ALAPYIP,包括靶向PD-L1的CLQKTPKQC、自组装连接子FF和募集E3连接酶ALAPYIP)进行自组装而构建了平均大小为211.8 nm的PT-NPs。PT-NPs可与肿瘤细胞表面的PD-L1强烈结合,以形成PD-L1/PT-NPs复合物,然后可通过受体介导的内吞作用内化,并在溶酶体中发生降解。研究发现,PT-NPs释放到细胞质的游离PROTAC能够通过泛素-蛋白酶体系统进一步诱导细胞质PD-L1发生持久的蛋白水解。
(2)在结肠肿瘤模型中,静脉注射的PT-NPs能够通过纳米颗粒的被动和主动靶向作用在肿瘤组织内显著积累。实验结果表明,PT-NPs可在靶向的肿瘤组织中实现持久的PD-L1降解,以引发抗肿瘤免疫应答。综上所述,该研究为合理设计自组装肽衍生的PROTAC纳米颗粒以实现精准增强的癌症治疗提供了新的见解。
Yujeong Moon. et al. Self-assembled Peptide-derived Proteolysis-targeting Chimera (PROTAC) Nanoparticles for Tumor-targeted and Durable PD-L1 Degradation in Cancer Immunotherapy. Angewandte Chemie International Edition. 2024
DOI: 10.1002/anie.202414146
https://onlinelibrary.wiley.com/doi/10.1002/anie.202414146



















