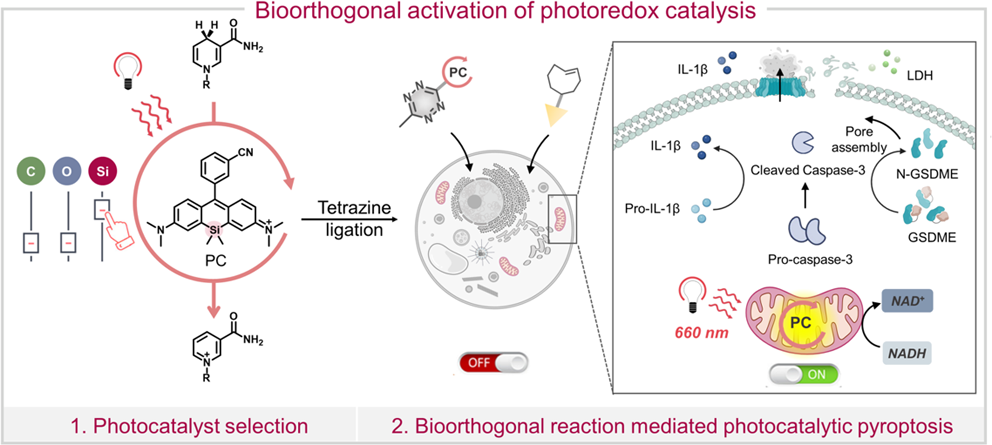
光氧化还原催化过程是一种能够用于疾病治疗和诊断的创新生物技术。然而,由于存在靶向性不足、与复杂生物环境的相容性低以及与光催化剂毒性相关的安全风险等问题,因此如何将人工光氧化还原催化与生命系统进行整合仍是一项严峻的挑战。有鉴于此,高丽大学Jong Seung Kim、Yunjie Xu、爱丁堡大学Marc Vendrell、特拉华大学Joseph M. Fox、深圳大学李明乐教授和成均馆大学Jin Yong Lee开发了一种生物正交活化的光氧化还原催化新方法。
本文要点:
(1)在该方法中,研究者通过替换罗丹明内核的原子开发了生物正交活化的光催化剂(PC-Tz)。引入的1,2,4,5-四嗪能够淬灭其光催化性能,并可与位于线粒体的反式环辛烯(TCO)发生胞内反电子需求的Diels−Alder(iEDDA)反应,以实现光催化性能的恢复。研究发现,该反应会导致烟酰胺腺嘌呤二核苷酸(NADH)发生显著的光催化氧化,进而可在癌细胞乏氧条件下有效地操控线粒体电子传递链(ETC)。
(2)实验结果表明,PC-Tz可通过caspase-3/gasdermin E(GSDME)通路实现光催化焦亡性细胞死亡,进而能够产生显著的抗肿瘤效果,并导致肿瘤细胞中三磷酸腺苷(ATP)的减少。综上所述,该研究首次实现了生物正交激活的光氧化还原催化,其能够在特定的细胞器中对活性进行时空控制,并且不会破坏其它的天然生物过程。
Jungryun Kim. et al. Bioorthogonal Activation of Deep Red Photoredox Catalysis Inducing Pyroptosis. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c13131
https://pubs.acs.org/doi/10.1021/jacs.4c13131



















