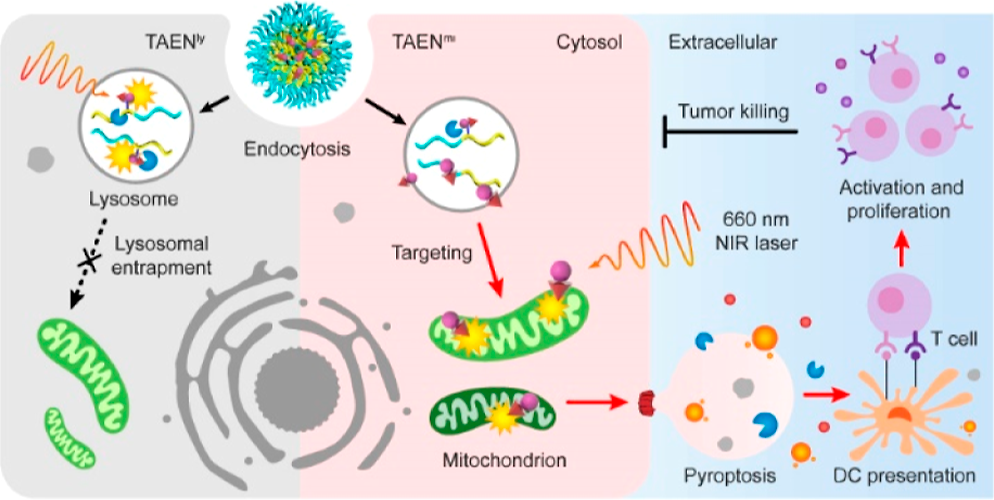
载荷的亚细胞分布是决定细胞命运和治疗效果的重要因素。然而,如何将治疗药物精确递送到特定的细胞内靶点仍是一项严峻的挑战。有鉴于此,北京大学汪贻广教授和陈斌龙研究员开发了一个酸/酶门控的三模块纳米平台(TAEN),其在酸性核内体中会发生解组装,随后会被溶酶体组织蛋白酶B切割,导致释放的货物能够被有效、靶向地运输到线粒体区室。
本文要点:
(1)研究者成功地利用该纳米载体将光敏剂分子选择性地分选到线粒体中(共定位系数高达0.98),进而能够在线粒体内特异性地产生活性氧应激,以实现基于焦亡的癌症治疗。研究发现,线粒体应激的诱导可触发固有的凋亡通路和caspase-3/gasderin-E(GSDME)级联,进而能够实现增强的癌细胞杀伤效果(与溶酶体应激相比提高了近2个数量级)。
(2)得益于其刺激先天和适应性免疫应答的卓越能力,该线粒体分选纳米光敏剂可在多种荷瘤小鼠模型中表现出强大的抗肿瘤免疫功效。综上所述,该研究不仅能够为开发用于亚细胞靶向递送的工程化纳米药物提供重要的见解,而且也为具有亚细胞分辨率的纳米生物学研究提供了一个新的工具。
Jianxiong Liu. et al. Lysosome-Mitochondria Cascade Targeting Nanoparticle Drives Robust Pyroptosis for Cancer Immunotherapy. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c12264
https://pubs.acs.org/doi/10.1021/jacs.4c12264



















