细胞外蛋白和跨膜蛋白是肿瘤中大约40%的蛋白质编码基因的产物,其在肿瘤免疫抑制微环境(TIME)的形成过程中具有至关重要的作用。虽然蛋白质降解疗法已被应用于癌细胞的膜蛋白,但其在免疫细胞中的应用仍鲜有报道。有鉴于此,南洋理工大学浦侃裔教授开发了一种聚合物纳米溶酶体靶向嵌合体(nano-LYTAC),其能够在M2巨噬细胞上进行膜蛋白降解,并产生声动力效应以实现癌症免疫联合治疗。
本文要点:
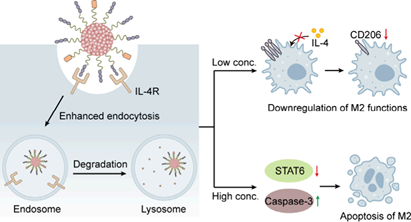
(1)与传统抑制剂相比,nano-LYTACs对白细胞介素4受体(IL-4R)具有更高的降解效率。研究发现,nano-LYTACs对M2巨噬细胞功能的影响具有浓度依赖性:在低浓度条件时下调M2巨噬细胞的CD206表达和白细胞介素10(IL-10)分泌;在高浓度条件时则会触发M2巨噬细胞凋亡。此外,nano-LYTACs也能够实现长时间的肿瘤滞留(48小时),可在一次注射后进行多次声动力治疗。
(2)在临床前动物模型中,由nano-LYTACs介导的协同声动力-免疫疗法能够抑制M2巨噬细胞和调节性T细胞(Tregs)的功能,促进树突状细胞(DCs)的成熟和T效应细胞(Teffs)的肿瘤浸润,以有效重编程TIME,完全抑制肿瘤生长,抑制肺转移,并防止肿瘤复发。
Mengke Xu. et al. Sonodynamic Nano-LYTACs Reverse Tumor Immunosuppressive Microenvironment for Cancer Immunotherapy. Journal of the American Chemical Society. 2024
DOI: 10.1021/jacs.4c13022
https://pubs.acs.org/doi/10.1021/jacs.4c13022



















