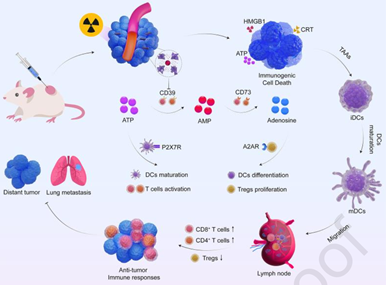
放射治疗(RT)可触发肿瘤细胞的免疫原性细胞死亡(ICD)和释放三磷酸腺苷(ATP),以激活抗肿瘤免疫。然而,由CD39和CD73等外核苷酸酶介导的免疫抑制腺苷(ADO)的形成会加重免疫抑制作用。有鉴于此,苏州大学杨光保教授在大肠杆菌Nissle 1917(EcN)表面原位合成了一种由铋(Bi)和鞣花酸(EA)组成的基于放射增敏剂的金属有机骨架(MOF),其能够作为CD39抑制剂聚钨酸钠(POM-1)的载体。
本文要点:
(1)该治疗平台可作为放射增敏剂以显著增强对肿瘤细胞的毒性,并有效诱导ICD和释放高浓度ATP。随后,释放的POM-1能够增加促炎性细胞外ATP的水平,并同时防止ADO积累引起的肿瘤免疫抑制。研究发现,作为天然免疫佐剂的EcN也可进一步促进树突状细胞(DCs)的成熟和细胞毒性T淋巴细胞(CTL)的浸润。
(2)实验结果表明,该研究设计的治疗策略能够破坏原发肿瘤的生长,并诱导产生强烈的远端效应,以显著抑制肿瘤转移。综上所述,该研究开发了一种基于细菌的生物杂化系统,其可增强RT诱导的ICD,并同时限制ATP降解为ADO,从而能够产生持续的抗肿瘤免疫。
Xirui Wu. et al. Bacteria-Based Biohybrids for Remodeling Adenosine Mediated Immunosuppression to Boost Radiotherapy-Triggered Antitumor Immune Response. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224005362



















